题目内容
原子的第一电离能为I1,第二电离能为I2,它们大小关系通常为( )
| A、I1=I2 |
| B、I1<I2 |
| C、I1>I2 |
| D、不能确定 |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:第一电离能I1是指气态原子处于基态时,失去第一个电子成为气态阳离子所需的能量,第二电离能为I2是指气态原子处于基态时,失去第二个电子成为气态阳离子所需的能量,再根据失电子的能力来判断;
解答:
解:第一电离能I1是指气态原子处于基态时,失去第一个电子成为气态阳离子所需的能量,第二电离能为I2是指气态原子处于基态时,失去第二个电子成为气态阳离子所需的能量,又因为第一个电子比第二个电子容易失去,所以I1<I2,故选:B;
点评:主要考查电离能的定义,注意从结构上理解电离能大小的原因.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
某原子的基态电子排布为1s22s22p63s23p63d64s2,该元素不可能的价态是( )
| A、-1 | B、+2 | C、+3 | D、0 |
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、铁与足量稀硝酸反应,1 mol Fe失去电子数为3NA |
| B、常温常压下,22.4L 乙烯中含极性共价键数目为5NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA |
某强碱性溶液中含有的离子是K+、NH4+、A13+、AlO2-、CO32-、SiO32-、Cl-中的某几种,现进行如下实验:
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
③另取一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.2153g.
下列说法中正确的是( )
①取少量的溶液用硝酸酸化后,该溶液无沉淀生成;
②另取一定量原溶液,逐滴加入盐酸至过量,发生的现象是:开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
③另取一定量的原溶液中加入5mL0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.2153g.
下列说法中正确的是( )
| A、该溶液中一定不含NH4+、A13+、SiO32-、Cl- |
| B、该溶液中一定含有A13+、CO32-、Cl- |
| C、该溶液中一定含有K+、AlO2-、CO32-、Cl- |
| D、Cl-可能含有 |
下列实验方案合理的是( )
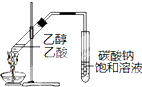

| A、配制银氨溶液:质量分数为2% 氨水中加入过量的硝酸银溶液 |
| B、制备乙酸乙酯:用如右图所示的实验装置 |
| C、鉴定溴乙烷中的溴原子:向溴乙烷中加入硝酸酸化的硝酸银溶液 |
| D、鉴别地沟油和矿物油:加入足量氢氧化钠溶液加热 |
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 |
| B、1mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、1L0.1mol?L-1氨水含有0.1lNA个OH- |
| D、1mol甲醇中含有C-H键的数目为3NA |
 某溶液中可能含有H+、NH4+、Na+、Mg2+、Al3+、Fe2+、CI-、CO32-、NO3-中的几种.①若加入锌粒,产生无色无味的氢气;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.回答下列问题:
某溶液中可能含有H+、NH4+、Na+、Mg2+、Al3+、Fe2+、CI-、CO32-、NO3-中的几种.①若加入锌粒,产生无色无味的氢气;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.回答下列问题: