题目内容
2.下列实验操作,对实验结果不产生影响的是( )| A. | 在淀粉溶液中加入稀硫酸加热一段时间后,再滴加银氨溶液检验淀粉的水解产物 | |
| B. | 测定中和反应的反应热时,将碱溶液缓慢倒入酸溶液中 | |
| C. | 用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH | |
| D. | 用酸碱中和滴定法测定未知浓度的碱液时,在锥形瓶中加入2-3mL酚酞试液作指示剂 |
分析 A.水解后检验葡萄糖,应在碱性条件下;
B.将碱溶液迅速与酸混合;
C.硫酸钠溶液为中性;
D.测定未知浓度的碱液时,加指示剂几滴即可.
解答 解:A.水解后检验葡萄糖,应在碱性条件下,则没有加碱至碱性,不能检验葡萄糖,故A错误;
B.将碱溶液迅速与酸混合,不能缓慢倒入,应测定反应的最高温度,故B错误;
C.硫酸钠溶液为中性,则用蒸馏水湿润pH试纸后测定硫酸钠溶液的pH,对实验无影响,故C正确;
D.测定未知浓度的碱液时,加指示剂几滴即可,指示剂与酸碱反应,加2~3mL酚酞消耗标准液偏多,故D错误;
故选C.
点评 本题考查化学实验方案的评价,为高频考点,把握有机物的性质实验、中和滴定、中和热测定、pH测定为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
12.25℃时,将amol/L、pH=m的一元酸HX溶液与bmol/L、pH=n的NaOH溶液等体积混合后pH>7.下列说法正确的是( )
| A. | 若a=b,则m+n<14 | |
| B. | 若a=b,则HX一定是弱酸 | |
| C. | 反应后溶液中一定存在c(Na+)>c(X-)>c(OH-)>c(H+) | |
| D. | 若a=2b,则反应后溶液中一定存在2c(OH-)=c(HX)+2c(H+) |
13.在容积不变的密闭容器中进行反应X(g)+Y(g)?2Z(g)+W(s),己知反应中X、Y 的起始浓度分别为0.1mol•L-1、0.2mol•L-1,在一定条件下,当反应达到化学平衡时,各物质的浓度可能是( )
| A. | X为0.05 mol•L-1 | B. | Y为0.1 mol•L-1 | C. | Z为0.2 mol•L-1 | D. | W为0.1 mol•L-1 |
17.下列说法中不正确的是( )
| A. | 碱金属元素锂、钠、钾、铷、铯,随着核电荷数的增加其单质的熔沸点逐渐降低 | |
| B. | 卤族元素氟、氯、溴、碘,随着核电荷数的增加其单质的熔沸点逐渐升高 | |
| C. | NaOH、KOH、Mg(OH)2的碱性依次减弱 | |
| D. | 在周期表中金属与非金属的分界处可以找到半导体材料 |
7.有关下列装置说法正确的是( )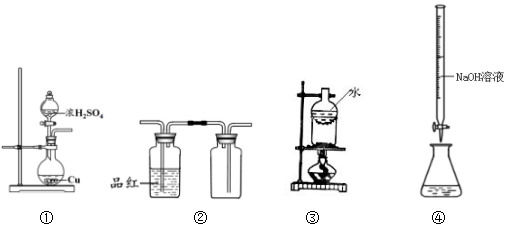

| A. | 用装置①制备SO2 | B. | 用装置②检验和收集SO2 | ||
| C. | 用装置③分离NaCl和I2 | D. | 用装置④测定溶液中c(H+) |
11. “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
 “天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )
“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将太阳能电池电解水技术与氢氧燃料电池技术相结合的可充电电池.下图为RFC工作原理示意图(隔膜为质子选择性透过膜),下列说法中正确的是( )| A. | c极上发生的电极反应是:O2+4H++4e-═2H2O | |
| B. | 当有0.1mol电子转移时,b极产生1.12L 气体Y(标准状况下) | |
| C. | 装置I与装置II的电解质溶液中,氢离子运动方向相反 | |
| D. | RFC系统工作过程中只存在3种形式的能量转化 |
2. 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
①2H2(g)+O2(g)══2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)══CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)══CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1.
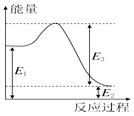
(2)若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ
B.E2=36kJ
C.E1-E2=36kJ
D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1=a kJ•mol-1(CO结构式为C≡O).又知某些化学键的键能数值如表:
则a=-116,在相应的反应条件下,将1mol CO(g)与足量H2混合充分反应后,放出或吸收的热量为QkJ,
则Q<|a|(用>,<或=填空).
 甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:
甲烷、一氧化碳和氢气、甲醇等既是重要的燃料也是重要的化工原料.已知:①2H2(g)+O2(g)══2H2O(l)△H1=-571.6kJ•mol-1
②CH4(g)+$\frac{1}{2}$O2(g)══CO(g)+2H2(g)△H2=-36kJ•mol-1
③CH4(g)+H2O(g)══CO(g)+3H2(g)△H3=+216kJ•mol-1
(1)写出甲烷不完全燃烧生成一氧化碳和液态水的热化学方程式:CH4(g)+$\frac{3}{2}$O2(g)═CO(g)+2H2O(l)△H=-607.6 kJ•mol-1.
(2)若②反应过程中能量转化过程如图所示,下列有关说法中正确的是C.
A.E1=36kJ
B.E2=36kJ
C.E1-E2=36kJ
D.E3-E1=36kJ
(3)工业上可通过CO和H2化合制得CH3OH:CO(g)+2H2(g)?CH3OH(g)△H1=a kJ•mol-1(CO结构式为C≡O).又知某些化学键的键能数值如表:
| 化学键 | C-C | C-H | H-H | C-O | C≡O | H-O |
| 键能 (kJ•mol-1) | 348 | 413 | 436 | 358 | 1072 | 463 |
则Q<|a|(用>,<或=填空).
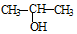 与NaOH的醇溶液共热制备CH3-CH═CH2
与NaOH的醇溶液共热制备CH3-CH═CH2