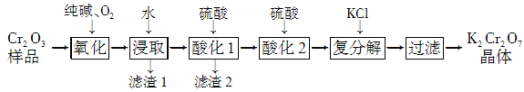
题目内容
【题目】下列变化需克服相同类型作用力的是( )
A.氯化氢和氯化钾的溶解 B.硅和NaCl的熔化
C.碘和干冰的升华 D.溴和汞的汽化
【答案】C
【解析】
试题分析:A.HCl和KCl溶解克服的作用力分别为共价键、离子键,故A错误;B.硅熔化时克服的作用力是共价键,NaCl是离子化合物,熔化时克服的作用力是离子键,故B错误;C.碘与干冰的升华,克服的作用力均为分子间作用力,故C正确;D.溴与汞的汽化克服的作用力分别为分子间作用力、金属键,故D错误。故选C。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】[化学-选修3:物质结构与性质]
氧族元素是指位于元素周期表第16列的元素,包括氧、硫、硒(Se)、碲(Te)、钋(Po)五种元素。
请回答下列问题:
(1)与氧同周期的相邻元素中,第一电离能由大到小的顺序为_______________。
(2)臭鼬排放的臭气主要成分为3-MBT(3-甲基-2-丁烯硫醇,结构如下图)。
![]()
1mol3-MBT中含有σ键数目为_______________(NA为阿伏伽德罗常数的值)。沸点:3-MBT____________(CH3)2C=CHCH2OH(填“高于”或“低于”),主要原因是___________________。
(3)S有+4和+6两种价态的氧化物。
①下列关于气态SO3和SO2的说法中正确的是_____________(填选项字母)。
A.中心原子的价层电子对数目相等 |
B.都是极性分子 |
C.中心原子的孤对电子数目相等 |
D.都含有极性键 |
②SO3分子的空间构型为________,与其互为等电子体的阴离子为_____________(举一例)。将纯液态SO3冷却到289.8K时凝固得到一种螺旋状单链结构的固体,其结构如图,此固态SO3中S原子的杂化轨道类型是_______。

(4)元素X与硒同周期,X元素原子核外未成对电子数最多,X为________(填元素符号),X的基态原子的电子排布式为_______。
(5)单质钋是由_____键形成的晶体;若已知Po的摩尔质量为Mg·mol-1,原子半径为r pm,阿伏伽德罗常数的值为NA,则钋晶体的密度的表达式为_________g/cm3