题目内容
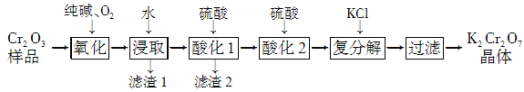
【题目】某Cr2O3样品中含有少量Al2O3、MgO等杂质。实验室以此样品为主要原料制取重铬酸钾(K2Cr2O7)的流程如下:
已知:2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
(1) 上述氧化过程中,若将1 mol Cr2O3转化成Na2CrO4,消耗氧气的体积(标准状况)是________。
(2) 酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 mol·L-1,需调节溶液pH的范围是________。
已知:Al(OH)3(s) ![]() H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
H++AlO2-+H2O的K=1×10-14;Ksp[Al(OH)3]=1×10-33
(3)酸化2后所得溶液加入KCl发生复分解反应,该反应能发生的原因是_________________。
(4) 称取重铬酸钾试样2.40 g 配成250 mL溶液,取出25.00 mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,然后加入适量水和数滴淀粉指示剂,用0.24 mol·L-1 Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-===2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL。求所得产品中重铬酸钾的质量分数(写出计算过程)。
【答案】(1)33.6 L;
(2)5~8;
(3)K2Cr2O7溶解度比Na2Cr2O7更小
(4)根据题意得关系式K2Cr2O7~3I2~6Na2S2O3,则:
n(K2Cr2O7)=![]() ×n(Na2S2O3)=
×n(Na2S2O3)=![]() ×0.24 mol·L-1×0.020 L=0.000 8 mol
×0.24 mol·L-1×0.020 L=0.000 8 mol
m(K2Cr2O7)试样=0.000 8 mol×294 g·mol-1×![]() =2.352 g
=2.352 g
w(K2Cr2O7)=![]() ×100% =98.0%
×100% =98.0%
【解析】
试题分析:流程分析可知,某Cr2O3样品中含有少量Al2O3、MgO等杂质,反应器中加入纯碱和氧气,将 Cr2O3转化成Na2CrO4,浸取过滤得到滤液调节溶液PH除去铝和镁离子,过滤得到Na2CrO4溶液,酸化后加入氯化钾浓缩过滤干燥得到重铬酸钾。
(1)若将1mol Cr2O3转化成Na2CrO4,Cr2O3~2Na2CrO4~6e-,O2~4e-,
得到2Cr2O3~3O2~12e-,
2 3
1mol 1.5mol
消耗标准状况下氧气的体积=1.5mol×22.4L/mol=33.6L,故答案为:33.6;
(2)依据电离平衡常数和溶度积常数计算所需溶液的pH范围,Al(OH)3(s)![]() H++AlO2-+H2O的K=c(AlO2-)×c(H+)=1×10-14,c(H+)=10-8mol/L,溶液pH=8,Kap[Al(OH)3]=c(Al3+)×c3(OH-)=1×10-33 ,c(OH-)=10-9mol/L,c(H+)=10-5mol/L,溶液pH=5,酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 molL-1,需调节溶液pH值的范围是5~8,故答案为:5~8;
H++AlO2-+H2O的K=c(AlO2-)×c(H+)=1×10-14,c(H+)=10-8mol/L,溶液pH=8,Kap[Al(OH)3]=c(Al3+)×c3(OH-)=1×10-33 ,c(OH-)=10-9mol/L,c(H+)=10-5mol/L,溶液pH=5,酸化1中为确保溶液中Al3+、AlO2-浓度均不超过10-6 molL-1,需调节溶液pH值的范围是5~8,故答案为:5~8;
(3)操作中加入KCl的原因温度对氯化钠的溶解度影响小,但对重铬酸钾的溶解度影响较大,K2Cr2O7 溶解度小于Na2Cr2O,利用复分解反应,可得到重铬酸钾;故答案为:K2Cr2O7溶解度比Na2Cr2O7更小;
(4)称取重铬酸钾试样2.40g配成250mL溶液,取出25.00mL于碘量瓶中,加入稀硫酸和足量碘化钾(铬被还原为Cr3+)并放于暗处6min左右,反应为Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,然后加入适量水和数滴淀粉指示剂,用0.24molL-1Na2S2O3标准溶液滴定至终点(发生反应:I2+2S2O32-=2I-+S4O62-,杂质不参与反应),共用去Na2S2O3标准溶液20.00mL,依据反应的定量关系为:
K2Cr2O7 ~ 3I2 ~ 6Na2S2O3
1 6
0.24molL-1 ×0.020L n
n=0.0008mol,称取重铬酸钾试样2.40g配成250mL溶液中重铬酸钾质量,m(K2Cr2O7) = 0.0008 mol × 294 g/mol × ![]() = 2.352g,产品中重铬酸钾的质量分数 =
= 2.352g,产品中重铬酸钾的质量分数 = ![]() × 100% = 98.0%,
× 100% = 98.0%,
答:产品中重铬酸钾的质量分数=![]() ×100%=98.0%
×100%=98.0%

 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案
