题目内容
(9分)依据事实,写出下列反应的热化学方程式。
(1)在101kPa时,H2在1.00molO2中完全燃烧生成2.00mol液态H2O。 放出571.6kJ的热量,
表示H2燃烧的热化学方程式为_____ _____ ____。
(2)在25℃、101kPa下,1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ。 则表示甲醇
燃烧热的热化学方程式为__________________________________________ ______
(3)已知:已知:C(s)+O2(g)=CO2(g) ΔH=-437.3 kJ·mol一1
H2(g)+ O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1
O2(g)=H2O(g) ΔH=-285.8 kJ·mol一1
CO(g)+ O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol一1
则煤的气化主要反应(碳和水蒸气反应生成一氧化碳和氢气)的热化学方程式是
_______________________________________
(1) H2(g) + 1/2O2(g)=2H2O(l) △H=-285.8kJ·mol-1。(2分)
(2) CH3OH(l)+ 3/2O2(g)=CO2(g)+2H2O ΔH=–725.76kJ·mol-1
(3) C(s) + H2O(g) =CO(g) + H2(g) ΔH=+131.5 kJ·mol-1
【解析】
试题分析:(1)根据“H2在1.00molO2中完全燃烧生成2.00mol液态H2O放出571.6kJ的热量”可写出该反应的热化学方程式:2H2(g) +O2(g) =2 H2O(l) ΔH= -571.6kJ/mol,将该方程式H2的变为1,就得到H2燃烧的热化学方程式:H2(g) + 1/2O2(g)=2H2O(l) ΔH= -258.8kJ/mol。(2)1g甲醇液体燃烧生成CO2和液态水时放热22.68kJ那么1molCH3甲醇燃烧放出的热量为:22.68kJ×32=725.76kJ,所以甲醇燃烧热的热化学方程式为:CH3OH(l)+ 3/2O2(g)=CO2(g)+2H2O ΔH=–725.76kJ·mol-1
(3)根据题目的信息知道碳和水蒸气反应是:C(s) + H2O(g) =CO(g) + H2(g),将这个反应看出总反应,给出的三个反应看成分反应,标为①、②、③,将这三个反应做这样的转换:①-②-③可得总反应,则总反应的ΔH=-437.3-(-285.8)-(-283.0)=+131.5 kJ·mol-1,所以煤的气化主要反应的热化学方程式是:C(s) + H2O(g) =CO(g) + H2(g) ΔH=+131.5 kJ·mol-1
考点:热化学方程式的书写和计算。

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
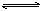 r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是
r C(g)在密闭容器中进行。下图表示此反应在不同时间t,温度T和压强p与反应物B在混合气体中的百分含量(B%)的关系曲线。由曲线分析下列判断正确的是