题目内容
1.X、Y、Z、W是原子序数依次增大四种短周期主族元素,X和Z同主族,Y和W同主族,Y和W的原子序数之和是X和Z的原子序数之和的2倍,下列说法正确的是( )| A. | 离子半径大小:Z>Y | |
| B. | Z和Y、W都能形成A2B2型的化合物 | |
| C. | Y和W形成的氢化物的稳定性:W>Y | |
| D. | X、Y、Z、W四种元素形成的化合物水溶液一定显酸性 |
分析 X、Y、Z、W是原子序数依次增大四种短周期主族元素,X和Z同主族,Y和W同主族,可推知Y处于第二周期,Z、W处于第三周期,Y和W的原子序数之和是X和Z的原子序数之和的2倍,则Y、W原子序数之和最大为27,故X、Z的原子序数之和最大为13.5,则X不能处于第二周期,只能处于第一周期,故X为H元素、Z为Na,Y、W原子序数之和为22,令Y原子序数为a,则a+a+8=22,解得a=8,则Y为O元素、W为S元素,据此解答.
解答 解:X、Y、Z、W是原子序数依次增大四种短周期主族元素,X和Z同主族,Y和W同主族,可推知Y处于第二周期,Z、W处于第三周期,Y和W的原子序数之和是X和Z的原子序数之和的2倍,则Y、W原子序数之和最大为27,故X、Z的原子序数之和最大为13.5,则X不能处于第二周期,只能处于第一周期,故X为H元素、Z为Na,Y、W原子序数之和为22,令Y原子序数为a,则a+a+8=22,解得a=8,则Y为O元素、W为S元素.
A.电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:Z(Na+)<Y(O2-),故A错误;
B.Z和Y可以形成Na2O2、Z与W能形成Na2S2,故B正确;
C.非金属性Y(O)>W(S),故氢化物稳定性:Y>W,故C错误;
D.四种元素形成的化合物为NaHSO4、NaHSO3、Na2SO4.10H2O等,NaHSO4溶液呈酸性,但Na2SO4.10H2O溶液为中性,故D错误,
故选:B.
点评 本题考查结构性质位置关系应用,侧重考查学生分析推理能力,关键是确定元素相对位置,D选项为易错点,学生容易考虑硫酸氢钠、亚硫酸氢钠,忽略硫酸钠晶体等.

练习册系列答案
相关题目
11.常温下,下列物质不能与烧碱溶液反应的是( )
| A. | SiO2 | B. | Br2 | C. | CuCl2 | D. | Fe |
12.SO2+H2O?H2SO3的反应类型属于( )
| A. | 分解反应 | B. | 复分解反应 | C. | 置换反应 | D. | 化合反应 |
16.下列叙述正确的是( )
| A. | 晶体中不一定存在分子间作用力,但一定存在化学键 | |
| B. | 液态氟化氢中存在氢键,所以其沸点比氯化氢更高 | |
| C. | 向Fe(NO3)2溶液中通入过量的HI,最终Fe2+全部氧化成Fe3+ | |
| D. | 普通玻璃是将石灰石、石英、黏土在玻璃熔炉中高温熔融制得的 |
13.常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )
| A. | 该溶液中由水电离出的c(H+)=1×10-3mol•L-1 | |
| B. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,则该混合溶液中c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol/L的HA和NaA溶液等体积混合,若该混合溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的HA溶液与0.05mol•L-1的NaOH溶液等体积混合,则其所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-) |
8.在下列变化过程中,既有离子键被破坏又有共价键被破坏的是( )
| A. | 将MgCl2加热熔化 | B. | 烧碱溶于水 | C. | 将AlCl3溶于水中 | D. | 硫酸氢钠溶于水 |
9.根据下列实验或实验操作和现象,所得结论正确的是( )
| A | 用大理石盐酸反应制取CO2 气体,立即通入一定浓度Na2SiO3 溶液中 | 出现白色沉淀 | H2CO3酸性比H2SiO3酸性强 |
| B | 向某溶液先滴加硝酸酸化,再滴加BaCl2溶液 | 有白色沉淀生成 | 原溶液中含有SO42-、SO32-、HSO3-中一种几种 |
| C | 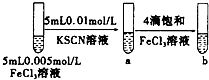 | 试管b比试管a中溶液红色深 | 增大反应物浓度,平衡向正反应方向移动 |
| D | 等体积PH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | HA放出的氢气多且反应速率快 | HA酸性比HB强 |
| A. | A | B. | B | C. | C | D. | D |
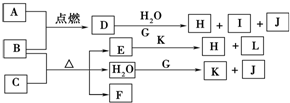
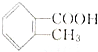 有多种同分异构体,其中属于酯类且分子结构中有甲基和苯环的同分异构体有5种.
有多种同分异构体,其中属于酯类且分子结构中有甲基和苯环的同分异构体有5种.