题目内容
13.常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,下列叙述正确的是( )| A. | 该溶液中由水电离出的c(H+)=1×10-3mol•L-1 | |
| B. | 由pH=3的HA溶液与pH=11的NaOH溶液等体积混合,则该混合溶液中c(Na+)>c(A-)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1mol/L的HA和NaA溶液等体积混合,若该混合溶液呈酸性,则c(A-)>c(HA)>c(Na+)>c(H+)>c(OH-) | |
| D. | 0.1mol•L-1的HA溶液与0.05mol•L-1的NaOH溶液等体积混合,则其所得溶液中2c(H+)+c(HA)=c(A-)+2c(OH-) |
分析 常温下,0.1mol•L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8,依据溶液中离子积常数计算酸溶液中氢离子浓度判断是强酸或弱酸,溶液中c(OH-)/c(H+)=1×10-8,c(H+)•c(OH-)=10-14,计算得到c(H+)=10-3mol/L,说明酸是弱酸,依据弱酸存在的电离平衡分析计算.
解答 解:A.溶液中c(OH-)/c(H+)=1×10-8,c(H+)•c(OH-)=10-14,计算得到c(H+)=10-3mol/L,由水电离的c(H+)=1×10-11mol/L,故A错误;
B.pH=3的HA的浓度大于pH=11的NaOH溶液的浓度,等体积混合后,酸剩余,混合液显示酸性,c(A-)>c(Na+)>c(H+)>c(OH-),故B错误;
C.浓度均为0.1mol/L的HA和NaA溶液等体积混合后,若溶液呈酸性,HA的电离程度大于A-的水解程度,所以c(A-)>c(HA),根据物料守恒可知c(A-)>c(Na+)>c(HA),所以溶液中离子浓度大小为:c(A-)>c(Na+)>c(HA)>c(H+)>c(OH-),故C错误;
D.0.1mol•L-1的HA溶液与0.05mol•L-1的NaOH溶液等体积混合,溶质为等浓度的HA和NaA,根据电荷守恒可知:c(A-)+c(OH-)=c(Na+)+c(H+),根据物料守恒可得:c(A-)+c(HA)=2c(Na+),二者结合得到:2c(H+)+c(HA)=c(A-)+2c(OH-),故D正确;
故选D.
点评 本题考查离子浓度大小比较,题目难度中等,正确判断HA为弱酸为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的 应用方法,试题培养了学生的灵活应用能力.

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
| A. | 该反应的氧化剂是ClO-,还原产物是N2 | |
| B. | 消耗1 mol还原剂,转移6 mol电子 | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 水是生成物,且反应后溶液的酸性明显增强 |
| A. | 二氧化硅的化学性质不活泼,能与强碱反应不与任何酸反应 | |
| B. | 生物炼铜就是利用植物对铜离子的吸收达到富集铜的目的 | |
| C. | 过量二氧化硫通入石蕊溶液中能使石蕊溶液先变红色后褪色 | |
| D. | 工业上利用氢气在氯气中燃烧生成氯化氢,再将氯化氢溶于水制得盐酸 |
| A. | 离子半径大小:Z>Y | |
| B. | Z和Y、W都能形成A2B2型的化合物 | |
| C. | Y和W形成的氢化物的稳定性:W>Y | |
| D. | X、Y、Z、W四种元素形成的化合物水溶液一定显酸性 |
| A. | 含有等物质的量的氢氧化钡、明矾两种溶液混合:3Ba2++6OH-+2Al3++3SO42-═3BaSO4+2Al(OH)3↓ | |
| B. | 纯碱溶液与胆矾溶液混合生成正盐、酸式盐、碱式盐:3CO32-+2Cu2++2H2O═2HCO3-+Cu2(OH)2CO3↓ | |
| C. | H218O中投入Na2O2固体:2H218O+2O22-═4OH-+18O2↑ | |
| D. | 0.1mol•L-1CuCl2溶液中加入0.1mol•L-1NaHS溶液:Cu2++HS-═CuS↓+H+ |
| A. | 向盐酸中滴加氨水:H++OH-═H2O | |
| B. | Fe(OH)3溶于硝酸:H++OH-═H2O | |
| C. | 在NH4Cl溶液中加入NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ | |
| D. | 在NH4HCO3溶液中加入足量NaOH溶液并加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$H2O+NH3↑ |
| A. | 卢瑟福首先提出了原子学说 | |
| B. | 地球上大量的溴蕴藏在大海中,因此溴被称为“海洋元素” | |
| C. | 利用同位素治疗肿瘤证明任何同位素对人都不会造成危害 | |
| D. | 利用焰色反应可以鉴别所有金属元素 |
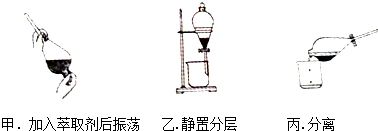 某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图:
某同学采用萃取-分液的方法从碘水中提取碘,主要操作步骤如图: