题目内容
Cu2+、Fe2+、Fe3+生成沉淀的pH如下:则在pH=4的溶液中能够大量共存的离子组是( )
| 物质 | Cu(OH)2 | Fe (OH)2 | Fe (OH)3 |
| 开始沉淀pH | 4.2 | 5.8 | 1.2 |
| 完全沉淀pH | 6.7 | 8.3 | 3.2 |
| A、Fe3+、Cu2+、Cl-、NO3- |
| B、Fe2+、K+、SO42-、NO3- |
| C、Cu2+、Na+、CO32-、SO42- |
| D、Fe2+、K+、SO42-、Cl- |
考点:难溶电解质的溶解平衡及沉淀转化的本质,离子共存问题
专题:电离平衡与溶液的pH专题
分析:根据Cu2+、Fe2+、Fe3+生成沉淀的pH判断pH=4的溶液中还剩哪些离子结合离子共存进行分析解答.
解答:
解:根据图表,则pH=4的溶液中三价铁已完全沉淀,
A、没有三价铁,故A错误;
B、因为在pH=4的溶液中,所以二价铁会被硝酸根氧化,故B错误;
C、铜离子与碳酸根不能大量共存,故C错误;
D、可以大量共存,故D正确;
故选:D.
A、没有三价铁,故A错误;
B、因为在pH=4的溶液中,所以二价铁会被硝酸根氧化,故B错误;
C、铜离子与碳酸根不能大量共存,故C错误;
D、可以大量共存,故D正确;
故选:D.
点评:主要考查了离子的共存问题,关键抓住离子之间的反应即可解题,难度不大.

练习册系列答案
相关题目
在给定条件的水溶液中能大量共存的粒子组是( )
| A、无色透明的溶液:Fe3+、K+、OH-、NO3- |
| B、与Al反应生成H2的溶液:Na+、Ma2+、NO3-、HCO3- |
| C、c(OH-)=1mol/L的溶液:K+、Ca2+、Cl-、H2SO3 |
| D、CH3COOH:SO42-、Cl-、Cu2+、NH4+ |
下列实验操作或装置正确的是( )
A、 制取氧气时选用装置 |
B、 量筒的度数 |
C、 高锰酸钾制取氧气 |
D、 过滤 |
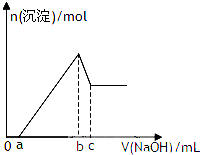 某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )
某无色透明酸性溶液,可能含有K+、Mg2+、Al3+、Cu2+、NH4+、Cl-、SO42-、NO3-中的几种,取该溶液三等份分别进行实验①加入少量Zn产生H2,②逐滴加人NaOH溶液,其加入量和沉淀生成量关系如图所示,③加入0.1mol/LBaCl2溶液至5ml时不再产生白色沉淀,取上层清液加入足量AgNO3溶液,得到0.287g沉淀,由此推知原溶液中( )| A、一定没有Cu2+、NO3-、Cl- |
| B、可能有K+、NH4+、NO3-、SO42- |
| C、不能确定是否含有K+、NO3- |
| D、一定有Mg2+、Al3+、Cl-、SO42- |
常温下,将Na2CO3和NaHCO3混合物〔
=a a≤3〕溶于水制得稀溶液,下列有关该溶液中微粒的物质的量浓度关系正确的是( )
| n(Na2CO3) |
| n(NaHCO3) |
| A、a=1则c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| B、a=2则c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C、a为任意值时,则c(Na+)+c(H+)=c(HCO3-)+2c(CO32-)+c(OH-) |
| D、a=0则c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+) |
向盛有I2水溶液的试管中,再加四氯化碳振荡,静置后观察到的现象是( )
| A、上层橙红色,下层接近无色 |
| B、均匀、透明、紫红色 |
| C、均匀、透明、无色 |
| D、上层接近无色,下层紫红色 |
在0.1mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH?CH3COO-+H+,对于该平衡,下列叙述正确的是( )
| A、加入水时,平衡逆向移动 |
| B、加入少量NaOH固体,平衡正向移动 |
| C、加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变 |
| D、加入少量CH3COONa固体,平衡正向移动 |
主链上有6个碳原子,含甲基、乙基两个支链的烷烃有( )
| A、2种 | B、4种 | C、8种 | D、12种 |
在水溶液中能大量共存的一组离子是( )
| A、HCO3-、H+、NO3-、Na+ |
| B、Na+、Cu2+、OH-、SO42- |
| C、Mg2+、H+、OH-、SO42- |
| D、NH4+、K+、Br-、NO3- |