题目内容
12.某电池示意图如图,该电池工作时,下列说法正确的是( )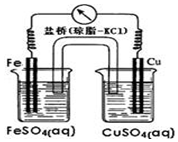
| A. | 铜作正极,发生氧化反应 | |
| B. | 外电路中电流方向为Fe→Cu | |
| C. | Fe电极的电极反应式为Fe-3e-=Fe3+ | |
| D. | 盐桥将两电解质溶液连接起来,传导电流,通过等量的K+和Cl-的定向移动,使两电解质溶液保持电中性 |
分析 由图可知,Fe为负极,Cu为正极,电子由负极流向正极,正极上铜离子得到电子,以此来解答.
解答 解:A、铜是正极发生还原反应,故A错误;
B、原电池电流由正极流向负极,所以电流方向为Cu→Fe,故B错误;
C、铁是负极发生氧化反应,生成亚铁离子,电极反应式为:Fe-2e-=Fe2+,故C错误;
D.盐桥作用可形成闭合回路,使离子移动到两个烧杯中,则作用为主要是离子通道和保持溶液电中性,故D正确;
故选D.
点评 本题考查原电池的工作原理,为高频考点,把握Fe、Cu原电池的工作原理、正负极及电极反应为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
2.氙气和氟气在一定条件下可反应达到平衡:Xe(g)+2F2(g)?XeF4(g)△H=-218kJ/mol.下列变化既能加快反应速率又能使平衡向正反应方向移动的是( )
| A. | 升高温度 | B. | 减压 | C. | 加压 | D. | 适当降温 |
1.某小组同学欲探究0.1mol/L Fe3+溶液与 0.1mol/L S2-溶液的反应.小组同学先进行理论预测,提出如下三种可能:
a. Fe3+与 S2-发生复分解反应
b. Fe3+与 S2-发生氧化还原反应
c. Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式2Fe3++3S2-=Fe2S3↓
(2)将预测b补充完整氧化还原,说明预测依据Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应.
在进行实验验证前,先进行资料收集,得到如表信息:
进行如表实验:
(3)写出黑色沉淀转变为黄色沉淀的离子方程式Fe2S3+4Fe3+=3S↓+6Fe2+.为进一步探究反应实质,该组同学进行了如下实验:
(4)步骤4与步骤1现象不同的原因可能是Fe3+量不足,不能氧化Fe2S3,而且体系中S2-不能还原Fe2S3,所以不能生成S
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS.请判断他的想法是否合理并说明理由合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS
(6)依据以上实验现象,可得出结论:Fe3+与S2-发生复分解反应.
a. Fe3+与 S2-发生复分解反应
b. Fe3+与 S2-发生氧化还原反应
c. Fe3+与 S2-发生互促水解反应
(1)依据预测a 写出该反应的离子方程式2Fe3++3S2-=Fe2S3↓
(2)将预测b补充完整氧化还原,说明预测依据Fe3+中Fe元素处于高价,可以降低,体现氧化性;S2-中S元素处于低价,可以升高,体现还原性,两者有可能发生氧化还原反应.
在进行实验验证前,先进行资料收集,得到如表信息:
| 物质 | 颜色 | 水中溶解性 |
| Fe2S3 | 黑色 | 难溶于水 |
| FeS | 黑褐色 | 难溶于水 |
| 实验步骤 | 操作 | 现象 | 备注 |
| 1 | 向2mL 0.1mol/L氯化铁溶液中逐滴滴入3滴0.1mol/L 硫化钠溶液 | 产生黑色沉淀,立即变为黄色沉淀,未见其它明显现象 | 自始至终都未见红褐色沉淀 |
| 2 | 继续滴加3滴0.1mol/L 硫化钠溶液 | 同上 | |
| 3 | 继续滴加0.1mol/L 硫化钠溶液至过量 | 产生黑色沉淀,振荡后静置,未发现明显变化 |
| 实验步骤 | 操作 | 现象 |
| 4 | 向2mL 0.1mol/L硫化钠溶液中逐滴滴入3滴0.1mol/L 氯化铁溶液 | 产生黑色沉淀,未见其它明显现象 |
| 5 | 继续滴加3滴0.1mol/L 氯化铁溶液 | 同上 |
| 6 | 继续滴加0.1mol/L 氯化铁溶液至过量 | 同上 |
(5)有同学认为步骤3中产生的黑色沉淀中可能有FeS.请判断他的想法是否合理并说明理由合理,依据实验现象,发现黑色沉淀不再转化为黄色硫沉淀,说明由于反应进行,造成Fe3+浓度降低,不足以氧化Fe2S3,Fe2+可能直接与S2-生成FeS
(6)依据以上实验现象,可得出结论:Fe3+与S2-发生复分解反应.
2.设NA为阿伏加德罗常数的值.下列说法不正确的是( )
| A. | 0.1molCH3+所含的电子数为8NA | |
| B. | T℃时,1L pH=6的纯水中含有1×10-6NA个OH- | |
| C. | 23g NO2和23g N2O4的混合气体所含原子数为3NA | |
| D. | 10g 46%的乙醇的水溶液中所含H原子数为0.6NA |
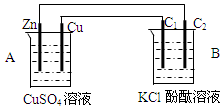 按图装置进行实验,并回答下列问题
按图装置进行实验,并回答下列问题