题目内容
9.根据下列实验事实,不能得到相应结论的是( )| 选项 | 实验操作和现象 | 结论 |
| A | 向2mol/L的醋酸溶液中加入镁条,产生气泡的速率先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| B | 常温下分别测等浓度的醋酸和氨水pH,发现二者的pH之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| C | 向均盛有2mL5%H2O溶液的两支试管中分别滴入0.2mol/LFe3+,和0.3mol/LCu2+溶液1mL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象 | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Mg与醋酸反应为放热反应,温度、浓度均可影响反应速率;
B.常温下分别测等浓度的醋酸和氨水pH,发现二者的pH之和为14,则醋酸铵为中性;
C.只有催化剂不同;
D.由现象可知不生成二氧化碳,则碳酸的酸性强.
解答 解:A.Mg与醋酸反应放热,后来氢离子浓度减小,则产生气泡的速率会先加快再减慢,不能说明反应刚开始时,醋酸电离平衡正移,c(H+)增大,且温度影响反应速率,故A错误;
B.常温下分别测等体积、等浓度的醋酸和氨水pH,发现二者的pH 之和为14,若二者混合生成醋酸铵,溶液为中性,可知二者电离程度相同,则常温下,醋酸和氨水的电离平衡常数相等,故B正确;
C.其它条件相同,FeCl3、CuCl2 只有金属阳离子不同,前者生成气泡的速率更快,则催化效果:Fe3+>Cu2+,故C正确;
D.观察到明显无现象可知二者不反应,则H3BO3的酸性弱于H2CO3,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意反应原理与实验的结合及实验评价性分析,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19.下列有关离子检验的操作、现象及结论均正确的是( )
| A. | 用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼烧,火焰呈黄色,则该溶液中一定不含K+ | |
| B. | 向无色溶液中加入盐酸酸化的BaCl2溶液有白色沉淀出现,则该溶液中一定含有SO42- | |
| C. | 向无色溶液中加入盐酸产生能使澄清石灰水变浑浊的气体,则该溶液中一定含有CO32- | |
| D. | 向某溶液中加入KSCN溶液无现象,再滴入少量H2O2,呈血红色,则该溶液中一定含有Fe2+ |
20.已知:H2(g)+I2(g)?2HI(g)的平衡常数为K1,$\frac{1}{2}$H2(g)+$\frac{1}{2}$I2(g)?HI(g)的平衡常数为K2,则K1和K2的关系为( )
| A. | K1=2K2 | B. | K1=K22 | C. | K1=K2 | D. | K1=$\sqrt{{K}_{2}}$ |
4.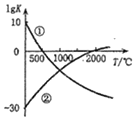 如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
①N2+3H2?2NH3;②N2+O2?2NO
根据图中的数据判断下列说法正确的是( )
 如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:
如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:①N2+3H2?2NH3;②N2+O2?2NO
根据图中的数据判断下列说法正确的是( )
| A. | 只有反应①是放热反应 | |
| B. | 升温,反应①的速率减小反应②的速率增大 | |
| C. | 可以在常温下利用反应①进行工业固氮 | |
| D. | 曲线的交点表示反应①和反应②体系中 N2 的转化率相等 |
14.下列关于有机化合物的说法正确的是( )
| A. | 苯的三氯代物一共有 5 种 | |
| B. | 乙烯和乙酸均能发生加成反应 | |
| C. | 乙烷通入氯水中能发生取代反应 | |
| D. | 淀粉和纤维素都属于天然高分子化合物 |
1.下列溶液中的Na+与50mL1mol/L Na3PO4溶液中Na+的物质的量浓度相等的是( )
| A. | 150 mL 3mol/L的NaCl溶液 | B. | 75 mL 2mol/LNaNO3溶液 | ||
| C. | 150 mL 2mol/L的Na2SO4溶液 | D. | 75 mL 1mol/L的Na2S溶液 |
19.下列广告用语在科学性上错误的是( )
| A. | 没有水就没有生命 | |
| B. | 这种蒸馏水绝对纯净,其中不含任何离子 | |
| C. | 这种口服液含丰富的氮、磷、锌等微量元素 | |
| D. | 这种饮料不含任何化学物质 |
 Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.该小组同学用Na2SO3与浓硫酸制备SO2,并把SO2通入NaNO3溶液中,他们为了检验产生的气体是NO还是
Na2SO3•7H2O是食品工业中常用的漂白剂、抗氧化剂和防腐剂.该小组同学用Na2SO3与浓硫酸制备SO2,并把SO2通入NaNO3溶液中,他们为了检验产生的气体是NO还是