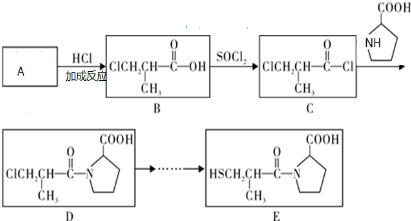
题目内容
将SO2通入BaCl2溶液至饱和,未见沉淀生成,继续通入另一种气体,仍无沉淀,则通入的气体可能是( )
| A、CO2 |
| B、NH3 |
| C、SO3 |
| D、Cl2 |
考点:二氧化硫的化学性质
专题:氧族元素
分析:盐酸酸性大于亚硫酸,所以二氧化硫和BaCl2溶液不反应,继续通入另一种气体,仍无沉淀,说明该气体不能和二氧化硫反应使二氧化硫转化为亚硫酸根离子或硫酸根离子,或该气体不和水反应生成含有亚硫酸根离子或硫酸根离子的物质,据此分析解答.
解答:
解:盐酸酸性大于亚硫酸,所以二氧化硫和BaCl2溶液不反应,继续通入另一种气体,仍无沉淀,说明该气体不能和二氧化硫反应使二氧化硫转化为亚硫酸根离子或硫酸根离子,或该气体不和水反应生成含有亚硫酸根离子或硫酸根离子的物质,
A.CO2和SO2不反应,所以符合条件,故A正确;
B.2NH3+SO2+H2O=(NH4)2SO3,生成的亚硫酸铵和氯化钡发生复分解反应生成亚硫酸钡白色沉淀,不符合条件,故B错误;
C.SO3+H2O=H2SO4,生成的硫酸和氯化钡发生复分解反应生成白色沉淀,所以不符合条件,故C错误;
D.Cl2+SO2+2H2O=2HCl+H2SO4,生成的硫酸和氯化钡发生复分解反应生成白色沉淀,所以不符合条件,故D错误;
故选A.
A.CO2和SO2不反应,所以符合条件,故A正确;
B.2NH3+SO2+H2O=(NH4)2SO3,生成的亚硫酸铵和氯化钡发生复分解反应生成亚硫酸钡白色沉淀,不符合条件,故B错误;
C.SO3+H2O=H2SO4,生成的硫酸和氯化钡发生复分解反应生成白色沉淀,所以不符合条件,故C错误;
D.Cl2+SO2+2H2O=2HCl+H2SO4,生成的硫酸和氯化钡发生复分解反应生成白色沉淀,所以不符合条件,故D错误;
故选A.
点评:本题考查物质之间的反应,涉及酸性强弱判断、氧化还原反应,明确物质的性质是解本题关键,注意氯气和二氧化硫之间的反应,题目难度不大.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
要除去二氧化碳气体中混有的少量HCl气体,最好的方法是将混合气体通过( )
| A、饱和碳酸氢钠溶液 |
| B、饱和碳酸钠溶液 |
| C、氢氧化钠溶液 |
| D、澄清石灰水 |
将氯水注入KI溶液中,用力振荡,再注入四氯化碳,振荡后静置,看到的现象是( )
| A、液体呈无色 |
| B、液体分两层,上层为紫色,下层接近无色 |
| C、液体呈紫红色 |
| D、液体分两层,上层接近无色,下层为紫色 |
不能由两种单质直接化合而成的是( )
| A、FeCl2 |
| B、Na2S |
| C、CuCl2 |
| D、SO2 |
下列各组反应,实质都是取代反应的是( )
| A、苯硝化,苯酚和溴水反应,皂化反应,乙烯与溴水反应 |
| B、酯的水解,酯化反应,乙醇和氢卤酸反应,乙醇和浓硫酸加热至140℃时的反应 |
| C、淀粉在硫酸存在下制葡萄糖,醛的氧化或还原 |
| D、纤维素水解,浓硫酸和乙醇在170℃时的反应,蛋白质水解 |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.