题目内容
在硫酸工业中,通过下列反应使SO2转化为SO3:2SO2+O2?2SO3△H<0,已知常压下平衡混合气体中SO3体积分数为91%.试回答:
(1)在生产中常用过量的空气是为了 .
(2)加热到400~500℃是由于 .
(3)压强采用 ,原因是 .
(4)常用浓硫酸来吸收SO2而不用水,因为 .
(1)在生产中常用过量的空气是为了
(2)加热到400~500℃是由于
(3)压强采用
(4)常用浓硫酸来吸收SO2而不用水,因为
考点:化学平衡的影响因素,化学平衡的调控作用
专题:化学平衡专题
分析:在硫酸工业中运用化学平衡原理选择适宜生产条件的能力,选择适宜的反应条件,要从浓度、压强、温度、催化剂等条件中考虑该反应的速率、转化率,同时还要考虑工业生产的实际情况和成本,硫酸工业中2SO2(g)+O2(g)
2SO3(g);△H<0,该反应为放热反应,升高温度平衡向逆反应分析移动,由于反应物气体体积大于生成物气体体积,则增大压强有利于平衡向正反应方向移动,题中实验数据表明反应在常压下反应的转化率较大,结合反应的实际和对设备的影响以及SO2和SO3的性质解答该题;(2)(4)两问是考虑速率问题,第(1)(3)问则是考虑化学平衡问题,且第(3)问要考虑生产的实际情况.
| ||
| △ |
解答:
解:(1)在生产中常用过量的空气,增大反应物浓度,有利于平衡向正反应分析移动,提高SO2的转化率;
故答案为:增大氧气浓度,提高成本较高的SO2的转化率;
(2)该反应为放热反应,升高温度平衡向逆反应分析移动,对SO2的转化不利,但升高温度可增大反应速率,主要考虑催化剂的活性,如温度过低,反应速率过慢,不利于工业生产,在此温度下,催化剂活性强,反应速率快,可缩短到达平衡的时间,提高单位时间内SO3的产率;
故答案为:在此温度下,催化剂活性强,反应速率快,可缩短到达平衡的时间,提高单位时间内SO3的产率;
(3)增大压强,反应速率增大,由于反应物气体体积大于生成物气体体积,则增大压强有利于平衡向正反应方向移动,但实验数据表明反应在常压下反应的转化率较大,无采用高压的必要,况且,采用高压还受动力、设备等条件的限制,提高了成本;
故答案为:常压;因常压下平衡混合气体中SO3的体积分数已达91%,若再加压,对设备动力系统要求高,成本高,加压实际意义不大;
(4)水和三氧化硫反应生成硫酸,反应放热,易形成酸雾而导致吸收效果差,但用浓H2SO4吸收则不易形成酸雾,吸收效果好;
故答案为:用水吸收易形成酸雾,降低吸收速率.
故答案为:增大氧气浓度,提高成本较高的SO2的转化率;
(2)该反应为放热反应,升高温度平衡向逆反应分析移动,对SO2的转化不利,但升高温度可增大反应速率,主要考虑催化剂的活性,如温度过低,反应速率过慢,不利于工业生产,在此温度下,催化剂活性强,反应速率快,可缩短到达平衡的时间,提高单位时间内SO3的产率;
故答案为:在此温度下,催化剂活性强,反应速率快,可缩短到达平衡的时间,提高单位时间内SO3的产率;
(3)增大压强,反应速率增大,由于反应物气体体积大于生成物气体体积,则增大压强有利于平衡向正反应方向移动,但实验数据表明反应在常压下反应的转化率较大,无采用高压的必要,况且,采用高压还受动力、设备等条件的限制,提高了成本;
故答案为:常压;因常压下平衡混合气体中SO3的体积分数已达91%,若再加压,对设备动力系统要求高,成本高,加压实际意义不大;
(4)水和三氧化硫反应生成硫酸,反应放热,易形成酸雾而导致吸收效果差,但用浓H2SO4吸收则不易形成酸雾,吸收效果好;
故答案为:用水吸收易形成酸雾,降低吸收速率.
点评:本题以硫酸的工业制备为载体,此题考查了在硫酸工业中运用化学平衡原理选择适宜生产条件的能力,综合考查化学平衡移动和影响平衡移动的因素,为高考常见题型,侧重于学生分析能力和数据处理能力的考查,注重于化学对生活、生产的指导,难度中等.

练习册系列答案
相关题目
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A、1mol Na2O2与足量的水反应,转移的电子数为2NA |
| B、7.1g Cl2完全参加反应,转移的电子数一定为0.2NA |
| C、常温常压下,0.56L甲烷中含有的共价键数为0.1NA |
| D、标准状况下,22.4L的CO2和O2组成的混合物中,含氧原子数为2NA |
将某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是( )
| A、若V1>V2,则说明HA的酸性比HB的酸性强 |
| B、若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C、若中和所得混合液的pH前者大于后者,则V1>V2 |
| D、若中和所得混合液的pH前者小于后者,则V1>V2 |
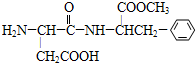 代糖是一种人工合成的甜味剂(sweetener),由于它不会被消化而变为能量共给身体所需,所以适合一些减肥人士食用.目前为止,天冬酰苯丙氨酸甲酯(aspartame)尚未有证据证实它是致癌物质,是糖的最佳代用品,比一般的蔗糖甜160倍.请根据图结构式判断下列关于aspartame的描述正确的是( )
代糖是一种人工合成的甜味剂(sweetener),由于它不会被消化而变为能量共给身体所需,所以适合一些减肥人士食用.目前为止,天冬酰苯丙氨酸甲酯(aspartame)尚未有证据证实它是致癌物质,是糖的最佳代用品,比一般的蔗糖甜160倍.请根据图结构式判断下列关于aspartame的描述正确的是( )| A、是芳香烃 |
| B、分子式是C14H19N2O5 |
| C、具有两性 |
| D、1mol aspartame最多能与3mol NaOH反应 |