题目内容
25℃,101kPa时,16g CH4(g)与适量O2(g)反应生成CO2(g)和H2O(l),放出890.3kJ热量,则CH4燃烧的热化学方程式为 .
考点:热化学方程式
专题:
分析:在25℃、101kPa下,16g甲烷(CH4)的物质的量为1mol,燃烧时消耗2mol氧气生成CO2和液态水时放热890.3kJ,书写热化学方程式时要标明物质的聚集状态.
解答:
解:1mol甲烷完全燃烧生成二氧化碳和液态水放热890.3KJ;故燃烧的热化学方程式为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1,
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
故答案为:CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.3kJ?mol-1
点评:本题考查热化学反应方程式的书写的相关知识,题目难度不大.应注意书写燃烧的热化学方程式和燃烧热的热化学方程式的区别.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列反应中,不能用离子方程式 SO42-+Ba2+=BaSO4↓来表示的是( )
| A、稀硫酸与硝酸钡溶液反应 |
| B、硫酸钾溶液与氯化钡溶液反应 |
| C、稀硫酸与氢氧化钡溶液反应 |
| D、硫酸钠溶液与硝酸钡溶液反应 |
足量铜与一定量浓硝酸反应得到硝酸铜溶液和NO2、N2O4、NO 的混合气体这些气体与1.12LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸.若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A、60mL | B、40mL |
| C、30mL | D、15mL |
常温下,把盐酸和氨水等体积混合后,其溶液的pH恰好等于7,则下列说法中正确的( )
| A、反应后的溶液一定c(NH4+)<c(Cl-) |
| B、盐酸的物质的量浓度一定小于氨水的物质的量浓度 |
| C、反应后生成的盐溶液一定没有发生水解 |
| D、盐酸中HCl的物质的量一定等于NH3?H2O的物质的量 |
下列各组物质只用胶头滴管和试管不能鉴别的是( )
| A、KOH溶液与AlCl3溶液 |
| B、MgCl2溶液与氨水 |
| C、NaAlO2溶液与盐酸 |
| D、Na2CO3溶液与盐酸 |

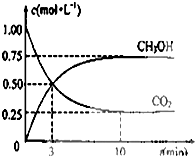 由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视.目前工业上有一种方法是用CO2生产燃料甲醇,一定条件下发生如下反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)