题目内容
14.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )| A. | pH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | c(H+)=1×10-13mol/L的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 加入铝粉产生氢气的溶液:Na+、K+、SO42-、Cl- | |
| D. | $\frac{c{(H}^{+})}{c({OH}^{-})}$=1×1014的溶液:Ca2+、Na+、ClO-、NO3- |
分析 A.pH=1的溶液为酸性溶液,碳酸根离子与酸性溶液中的氢离子反应;
B.c(H+)=1×10-13mol/L的溶液中存在电离氢离子或氢氧根离子,镁离子、铜离子与氢氧根离子反应;
C.加入铝粉产生氢气的溶液为酸性或强碱性溶液,四种离子之间不反应,都不与氢离子和氢氧根离子反应;
D.该溶液为酸性溶液,溶液中存在大量氢离子,次氯酸根离子与氢离子反应.
解答 解:A.pH=1的溶液中存在电离氢离子,CO32-与氢离子反应,在溶液中不能大量共存,故A错误;
B.c(H+)=1×10-13mol/L的溶液为酸性或碱性溶液,Mg2+、Cu2+与氢氧根离子反应,在碱性溶液中不能大量共存,故B错误;
C.加入铝粉产生氢气的溶液中存在电离氢离子或氢氧根离子,Na+、K+、SO42-、Cl-之间不反应,都不与氢氧根离子、氢离子反应,在溶液中能够大量共存,故C正确;
D.该溶液中存在大量的氢离子,ClO-与氢离子反应生成次氯酸,在溶液中不能大量共存,故D错误;
故选C.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等;试题侧重对学生基础知识的训练和检验,有利于提高学生灵活运用基础知识解决实际问题的能力.

练习册系列答案
相关题目
7.下列各表述与示意图一致的是( )
| A. | 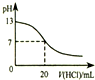 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 如图表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 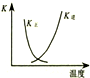 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 如图中曲线表示反应2SO2(g)+O2(g)?2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 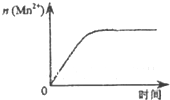 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 如图表示10 mL 0.0l mol•L-1KMnO4 酸性溶液与过量的0.1 mol•L-1H2C2O4 溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 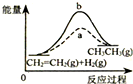 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 如图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g)+Q使用和未使用催化剂时,反应过程中的能量变化 |
10.下列有关热化学方程式的叙述正确的是( )
| A. | 含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.7kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为: NaOH(aq)+CH3COOH(aq)═CH3COONa(aq)+H2O(l)△H=-57.4kJ•mol-1 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知反应2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,则H2的燃烧热为571.6kJ•mol-1 | |
| D. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2,则△H1>△H2 |
5.将8mL NO2和O2的混合气体通入倒立于水槽中装满水的量筒,充分反应后,剩余气体为1mL,则原混合气体中NO2和O2的体积比可能为( )
| A. | 7:5 | B. | 3:7 | C. | 7:1 | D. | 1:7 |
2.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,22.4 L H2O含有的分子数为 NA | |
| B. | 16 g O2和O3组成的混合气体中含有的原子数为 NA | |
| C. | 1 mol•L-1A1Cl3溶液中含有的Cl-数目为3 NA | |
| D. | 2.3 g Na与足量水反应,转移的电子数目为0.2 NA |
 2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:其中正确的是
2C(g)。若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:其中正确的是