题目内容
19.如图表示有关的一种反应物或生成物(无关物质已略去),其中A、C、D为无色气体,化合物W为一种酸式盐.请填写下列空白.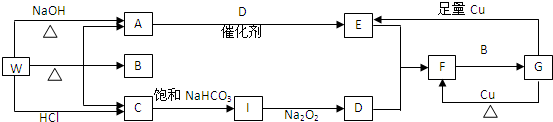
(1)化合物W是NH4HCO3,C是CO2.
(2)工业合成A的化学方程式为N2+3H2$?_{催化剂}^{高温、高压}$2NH3,A到E的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,G与Cu生成E的离子方程式为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O
(3)在I与Na2O2生成D的反应中,生成标准状况下5.6L气体D时转移的电子数目为0.5NA.
分析 A、C、D为无色气体,C可与过氧化钠反应,则C为CO2,C通过饱和碳酸氢钠是为了除去二氧化碳中的氯化氢气体,D为O2,化合物W为一种酸式盐,W与氢氧化钠反应生成气体,A一般为NH3,W是铵盐,为NH4HCO3,B为H2O,由转化关系可知E为NO,F为NO2,G为HNO3,浓度不同时,能和铜反应生成不同的气体,结合物质的性质进行解答.
解答 解:A、C、D为无色气体,C可与过氧化钠反应,则C为CO2,C通过饱和碳酸氢钠是为了除去二氧化碳中的氯化氢气体,D为O2,化合物W为一种酸式盐,W与氢氧化钠反应生成气体,A为NH3,W是铵盐,为NH4HCO3,B为H2O,由转化关系可知E为NO,F为NO2,G为HNO3,浓度不同时,能和铜反应生成不同的气体,
(1)A、C、D为无色气体,C可与过氧化钠反应,则C为CO2,C通过饱和碳酸氢钠是为了除去二氧化碳中的氯化氢气体,D为O2,化合物W为一种酸式盐,W与氢氧化钠反应生成气体,A为NH3,W是铵盐,为NH4HCO3,故答案为:NH4HCO3;CO2;
(2)工业合成氨气的化学方程式为N2+3H2$?_{催化剂}^{高温、高压}$2NH3,氨气催化氧化的化学方程式为4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O,硝酸与Cu反应生成二氧化氮的化学方程式为Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,故答案为:N2+3H2$?_{催化剂}^{高温、高压}$2NH3;4NH3+5O2$\frac{\underline{\;催化剂\;}}{△}$4NO+6H2O;Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(3)I为二氧化碳,二氧化碳与过氧化钠反应的化学方程式为2CO2+2Na2O2=2Na2CO3+O2,每生成1mol氧气,转移2mol电子,所以生成$\frac{5.6L}{22.4L/mol}$=0.25mol氧气转移0.5mol电子,转移电子数目为0.5NA,故答案为:0.5NA.
点评 本题考查无机物的推断以及元素化合物的性质,为高考常见题型,侧重于学生的分析能力的考查,题目难度中等,解答本题,在学习中要注意牢固掌握相关基础知识,易错点为(3),注意过氧化钠与水或二氧化碳反应时,每生成1mol氧气,转移2mol电子.

 一课一练课时达标系列答案
一课一练课时达标系列答案| A. | 2gH2所含的原子数目为NA | |
| B. | 标准状况下,22.4L水中含有水分子数为NA | |
| C. | 常温下,1L0.1mol•L-1的MgCl2溶液中含有的Cl-数为0.2NA | |
| D. | 常温常压下,11.2L CH4中含有的氢原子数为2NA |
| A. | 燃烧反应 | B. | 取代反应 | C. | 硝化反应 | D. | 加成反应 |
| A. | 石油的催化重整是为了获得以汽油为主的轻质油 | |
| B. | 芳香烃主要来自于煤干馏后的煤焦油 | |
| C. | 汽油、煤油、柴油主要来自于石油的常压蒸馏 | |
| D. | 乙烯可由石油裂解得到 |
| A. | Mg2+、NH${\;}_{4}^{+}$、OH-、SO${\;}_{4}^{2-}$ | B. | Na+、H+、Cl-、HCO${\;}_{3}^{-}$ | ||
| C. | Na+、K+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ | D. | H++、K+、MnO${\;}_{4}^{-}$、SO${\;}_{3}^{2-}$ |
| A. | B、C、D形成的简单离子半径大小顺序Cm+>Dn+>Bx-(m+、n+、x-表示所带电荷) | |
| B. | A、B、E气态氢化物稳定性为E>A>B | |
| C. | C和D的最高价氧化物对应的水化物之间可以发生反应 | |
| D. | E单质是制备太阳能电池的重要材料是因为E的单质导电性强 |
 和
和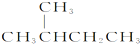
 和
和
 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的 一系列化学反应,其中①②③属于同种反应类型.根据图回答下列问题: ,反应类型加聚反应.
,反应类型加聚反应.