题目内容
汽车作为一种现代交通工具正在进入千家万户,汽车尾气中含有CO、NOx等有毒气体,其污染问题也成为当今社会急需解决的问题.
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
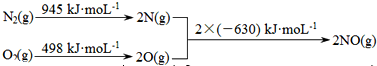
则该反应的热化学方程式为 .
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体.
2xCO+2NOx═2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下N2 L.
(3)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H=-bkJ?mol-1
①该反应的平衡常数表达式为 .
②若容器容积不变,下列措施可增加甲醇产率的是 .
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
③经测定不同温度下该反应的平衡常数如下:
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4mol/L、c(H2)=0.4mol/L、c(CH3OH)=0.8mol?L-1,则此时v正 v逆(填>、<或=).
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为 .电池工作时,固体电解质里的O2-向 极移动.
(1)汽车发动机工作时会引发N2和O2反应,其能量变化示意图如图:
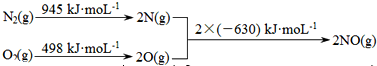
则该反应的热化学方程式为
(2)对汽车加装尾气净化装置,可使CO、NOx有毒气体相互反应转化为无毒气体.
2xCO+2NOx═2xCO2+N2,当转移电子物质的量为0.4x mol时,该反应生成标准状况下N2
(3)一氧化碳是一种用途相当广泛的化工基础原料.可以还原金属氧化物,还可以用来合成很多有机物如甲醇等.在压强为0.1MPa条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下反应生成甲醇:CO(g)+2H2(g)?CH3OH(g);△H=-bkJ?mol-1
①该反应的平衡常数表达式为
②若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充入1mol CO和3mol H2
③经测定不同温度下该反应的平衡常数如下:
| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
(4)甲醇是重要的基础化工原料,又是一种新型的燃料,最近有人制造了一种燃料电池,一个电极通入空气,另一个电极加入甲醇,电池的电解质是掺杂了Y2O3的ZrO2晶体,它在高温下能传导O2-离子.该电池的正极反应式为
考点:化学平衡的计算,热化学方程式,原电池和电解池的工作原理
专题:
分析:(1)根据能量变化图计算反应热,反应热=吸收的能量-放出的能量,再根据热化学反应方程式的书写规则书写;
(2)依据化学方程式中元素化合价变化计算电子转移总数,每生成1molN2电子转移0.4xmol电子计算
(3)①依据化学方程式和平衡常数概念书写平衡常数表达式;
②增加甲醇产率需要平衡正向进行,依据平衡移动原理结合反应特征是气体体积减小的放热反应分析选项判断;
③依据计算的浓度商和该温度下的平衡常数比较分析判断反应进行方向;
(4)根据原电池工作原理写出该电池正极反应式;根据电流方向及O2-离子所带电荷判断O2-移动方向.
(2)依据化学方程式中元素化合价变化计算电子转移总数,每生成1molN2电子转移0.4xmol电子计算
(3)①依据化学方程式和平衡常数概念书写平衡常数表达式;
②增加甲醇产率需要平衡正向进行,依据平衡移动原理结合反应特征是气体体积减小的放热反应分析选项判断;
③依据计算的浓度商和该温度下的平衡常数比较分析判断反应进行方向;
(4)根据原电池工作原理写出该电池正极反应式;根据电流方向及O2-离子所带电荷判断O2-移动方向.
解答:
解:(1)该反应中的反应热=(945+498)kJ/mol-2×630kJ/mol=+183kJ/mol,所以反应的热化学反应方程式为:N2(g)+O2(g)=2NO(g)△H=+183 kJ?moL-1,
故答案为:N2(g)+O2(g)=2NO(g)△H=+183 kJ?moL-1;
(2)反应2xCO+2NOx═2xCO2+N2中,NOx中N的化合价为+2x,生成1molN2电子转移为:2(2x-0)=4xmol电子,当转移电子物质的量为0.4xmol时,反应生成氮气0.1mol,标准状况下气体体积为0.1mol×22.4L/mol=2.24L;
故答案为:2.24;
(3)①CO(g)+2H2(g)?CH3OH(g)△H<0,反应的平衡常数为:K=
,
故答案为:
;
②A.升高温度,平衡逆向进行,甲醇产率减小,故A错误;
B.将CH3OH(g)从体系中分离,平衡正向进行,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,分压不变,平衡不动,故C错误;
D.再充入1mol CO和3mol H2,反应物浓度增大,平衡正向进行,甲醇产率增大,故D正确;
故答案为:BD;
③250℃测得该反应的反应物与生成物的浓度为:c(CO)=0.4mol?L-1、c(H2)=0.4mol?L-1、c(CH3OH)=0.8mol?L-1,
浓度商Q=
=12.5>K=2.041,说明反应逆向进行,即v正<v逆,
故答案为:<;
(4)燃料电池中正极得到电子发生还原反应,该甲醇燃料电池中正极空气中的氧气得到电子生成氧离子,发生的电极反应为:O2+4e-=2O2-;
电解质中,电流由负极流向正极,氧离子带有负电荷,与电流方向相反,则从正极流向负极,
故答案为:O2+4e-=2O2-;负.
故答案为:N2(g)+O2(g)=2NO(g)△H=+183 kJ?moL-1;
(2)反应2xCO+2NOx═2xCO2+N2中,NOx中N的化合价为+2x,生成1molN2电子转移为:2(2x-0)=4xmol电子,当转移电子物质的量为0.4xmol时,反应生成氮气0.1mol,标准状况下气体体积为0.1mol×22.4L/mol=2.24L;
故答案为:2.24;
(3)①CO(g)+2H2(g)?CH3OH(g)△H<0,反应的平衡常数为:K=
| c(CH3OH) |
| c(CO)c2(H2) |
故答案为:
| c(CH3OH) |
| c(CO)c2(H2) |
②A.升高温度,平衡逆向进行,甲醇产率减小,故A错误;
B.将CH3OH(g)从体系中分离,平衡正向进行,甲醇产率增大,故B正确;
C.充入He,使体系总压强增大,分压不变,平衡不动,故C错误;
D.再充入1mol CO和3mol H2,反应物浓度增大,平衡正向进行,甲醇产率增大,故D正确;
故答案为:BD;
③250℃测得该反应的反应物与生成物的浓度为:c(CO)=0.4mol?L-1、c(H2)=0.4mol?L-1、c(CH3OH)=0.8mol?L-1,
浓度商Q=
| 0.8 |
| 0.4×0.42 |
故答案为:<;
(4)燃料电池中正极得到电子发生还原反应,该甲醇燃料电池中正极空气中的氧气得到电子生成氧离子,发生的电极反应为:O2+4e-=2O2-;
电解质中,电流由负极流向正极,氧离子带有负电荷,与电流方向相反,则从正极流向负极,
故答案为:O2+4e-=2O2-;负.
点评:本题考查了原电池工作原理及其应用、化学平衡的计算、热化学方程式的书写等知识,题目难度中等,试题涉及的知识点较多,计算量较大,充分考查了学生的分析、理解能力及化学计算能力.

练习册系列答案
相关题目
实验中需0.2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3的质量分别是( )
| A、1000mL,21.2g |
| B、950mL,20.14g |
| C、任意规格,21.2g |
| D、500mL,10.6g |
下列溶液中有关物质的量浓度关系不正确的( )
| A、pH=2的HA溶液与pH=12的MOH溶液以任意比混合:c(H+)+c(M+)=c(OH-)+c(A-) |
| B、pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) |
| C、物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH) |
| D、0.1 mol?L-1的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(A2-)>c(H2A) |
 )
)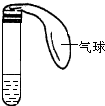 某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
某学生课外活动小组利用如图所示装置分别做如下实验:在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是
 根据中和热的测定实验填空.
根据中和热的测定实验填空.