题目内容
2.下列4组物质中均有一种物质的类别与其他3种不同.A.Fe2O3、Na2O、SO2、CuO
B.纯碱、氯化钠、氢氧化钡、硫酸钠
C.雾、Fe(OH)3胶体、稀豆浆、CuSO4
D.HCl、SiO2、H2SO4、HNO3
(1)以上4组物质中类别不同的物质依次是ASO2;B.氢氧化钡;C.CuSO4;D.SiO2.
(2)写出制备Fe(OH)3胶体的方法:向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热.
分析 (1)A.SO2为非金属氧化物,其它为金属氧化物;
B.氢氧化钡属于碱,其它为盐;
C.CuSO4属于溶液,其余属于胶体;
D.SiO2属于氧化物,其余的是酸;
(2)向沸水中逐滴滴入5~6滴FeCl3饱和溶液可以得到氢氧化铁胶体.
解答 解:(1)A.SO2为非金属氧化物,其它为金属氧化物;
B.氢氧化钡属于碱,其它为盐;
C.CuSO4属于溶液,其余属于胶体;
D.SiO2属于氧化物,其余的是酸,
故答案为:SO2;氢氧化钡;CuSO4;SiO2;
(2)制备Fe(OH)3胶体的方法:向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,
故答案为:向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热.
点评 本题考查了物质的分类和氢氧化铁胶体的制备,应掌握分类的学习方法,能对常见物质根据不同的分类标准进行分类,分类标准是审题的关键.

练习册系列答案
相关题目
12.点燃一根蜡烛,用冷碟底放在蜡烛火焰上方,过一会儿,在碟底收集到炭黑,由此能得出石蜡的组成中一定含有( )
| A. | 碳元素 | B. | 氢元素 | C. | 氧元素 | D. | 氢、氧元素 |
10.用活性炭还原法处理氮氧化物.有关反应为C(s)+2NO(g)?N2(g)+CO2(g).某研究小组向恒容密闭容器中加入一定量的活性炭和NO,恒温(T℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
(1)10~20min以v(CO2)表示的反应速率为0.009 mol•L-1•min-1.
(2)根据表中数据,计算T℃时该反应的平衡常数为0.56(保留两位小数).
(3)下列各项能作为判断该反应达到平衡标志的是CD(填序号字母).
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(4)30min时改变某一条件,反应重新达到平衡,则改变的条件可能是分离出了二氧化碳(减小CO2的浓度).
(5)一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”“不变”或“减小”).
| 物质浓度(mol/L)时间(min) | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 40 | 0.32 | 0.34 | 0.17 |
| 50 | 0.32 | 0.34 | 0.17 |
(2)根据表中数据,计算T℃时该反应的平衡常数为0.56(保留两位小数).
(3)下列各项能作为判断该反应达到平衡标志的是CD(填序号字母).
A.容器内压强保持不变 B.2v正(NO)=v逆(N2)
C.容器内CO2的体积分数不变 D.混合气体的密度保持不变
(4)30min时改变某一条件,反应重新达到平衡,则改变的条件可能是分离出了二氧化碳(减小CO2的浓度).
(5)一定温度下,随着NO的起始浓度增大,则NO的平衡转化率不变(填“增大”“不变”或“减小”).
17.某种中和胃酸的药物主要成分的化学式为Al2Mg6(OH)16CO3•4H2O.1molAl2Mg6(OH)16CO3•4H2O中,氧原子的物质的量为( )
| A. | 16mo1 | B. | 19 mol | C. | 20mol | D. | 23mol |
3.下列说法正确的是( )
| A. | 按系统命名法,化合物 的名称是2,5,5-三甲基-3-乙基庚烷 的名称是2,5,5-三甲基-3-乙基庚烷 | |
| B. | 将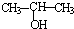 与NaOH的醇溶液共热可制备CH3-CH═CH2 与NaOH的醇溶液共热可制备CH3-CH═CH2 | |
| C. | 向柠檬醛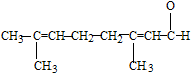 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 中加入酸性高锰酸钾,若溶液褪色,说明分子中含有醛基 | |
| D. | 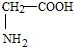 、 、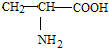 、 、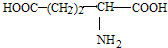 三种氨基酸脱水,最多可生成6种二肽 三种氨基酸脱水,最多可生成6种二肽 |
20.支撑“宇宙大爆炸”理论的重要事实之一是( )
| A. | 宇宙原子总数的88.6%是氢 | B. | 地球上的元素绝大多数是金属 | ||
| C. | 普鲁特“氢是元素之母”的预言 | D. | 宇宙中存在少量稀有气体分子 |
1.某种溶液仅含下表离子中的5种(不考虑水的电离与离子水解),且各种离子的物质的量均为1mol.
若向原溶液中加入足量的盐酸,有无色气体生成.经分析反应后溶液中阴离子的种类没有变化.
(1)溶液中一定不(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化.
(2)原溶液中所含的阴离子为Cl-、NO3-、SO42-,阳离子为Fe2+、Mg2+.
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为120g.
| 阳离子 | K+ Ba2+ Fe2+ Al3+ Fe3+ Mg2+ |
| 阴离子 | OH- HCO3- CO32- Cl- NO3- SO42- |
(1)溶液中一定不(填“一定”、“一定不”或“可能”)含有HCO3-或CO32-,理由是HCO3-与CO32-均可与盐酸反应生成二氧化碳,造成阴离子种类有所变化.
(2)原溶液中所含的阴离子为Cl-、NO3-、SO42-,阳离子为Fe2+、Mg2+.
(3)向原溶液中加入足量的盐酸,有无色气体生成的离子反应方程式为3Fe2++NO3-+4H+═3Fe3++NO↑+2H2O.
(4)若向原溶液中加入足量的氢氧化钠溶液,充分反应后将沉淀过滤、洗涤、干燥灼烧至恒重,得到固体质量为120g.