题目内容
16.用NA表示阿伏伽德罗常数的值,下列说法中正确的是( )①20g D2O含有的电子数为10NA
②含有1molFe(OH)3的氢氧化铁胶体中含有胶粒数为NA
③1L0.1mol/L的NH4NO3溶液中氮原子数为0.2NA
④在标准状况下22.4L SO3的物质的量为1mol
⑤25℃时,pH=12的l.0LNaClO溶液中水电离出的OH-的数目为0.01NA
⑥常温下,5.6L NO和5.6LO2的混合气体中含有的分子数为0.5NA
⑦l mol Na2O2与水完全反应时转移电子数为2NA.
| A. | ③⑥⑦ | B. | ①③⑤ | C. | ①②④ | D. | ④⑤⑥ |
分析 ①求出20g D2O的物质的量,然后根据重水中含10个电子来分析;
②一个Fe(OH)3胶粒是多个氢氧化铁的聚集体;
③求出1L0.1mol/L的NH4NO3溶液中硝酸铵的物质的量,然后根据硝酸铵中含2个N原子来分析;
④在标准状况下SO3为固体;
⑤25℃时,pH=12的NaClO溶液中OH-的浓度为0.01mol/L,且完全来自水的电离;
⑥NO和O2混合后发生反应生成二氧化氮;
⑦Na2O2与水的反应为过氧化钠中-1价氧元素的歧化反应.
解答 解:①20g D2O的物质的量为1mol,而重水中含10个电子,故1mol重水中含10NA个电子,故正确;
②一个Fe(OH)3胶粒是多个氢氧化铁的聚集体,故1mol氢氧化铁胶体中含有的胶粒的个数小于NA个,故错误;
③1L0.1mol/L的NH4NO3溶液中硝酸铵的物质的量n=CV=0.1mol/L×1L=0.1mol,而硝酸铵中含2个N原子,故0.1mol硝酸铵中含0.2NA个N原子,故正确;
④在标准状况下SO3为固体,故不能根据气体摩尔体积来计算其物质的量,故错误;
⑤25℃时,pH=12的NaClO溶液中OH-的浓度为0.01mol/L,且完全来自水的电离,故此溶液中水电离出的氢氧根的物质的量为0.01mol,个数为0.01NA个,故正确;
⑥NO和O2混合后发生反应生成二氧化氮,且NO2中存在平衡:2NO2?N2O4,导致气体分子个数减少,故最终分子个数小于0.5NA个,故错误;
⑦Na2O2与水的反应为过氧化钠中-1价氧元素的歧化反应,此反应中1mol过氧化钠转移1mol电子即NA个,故错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.

练习册系列答案
相关题目
6.25℃时,有amLpH=9的氨水(A)和bmLpH=10的氨水(B),cmLpH=10的NaOH溶液(C),它们能中和同量的盐酸.以下叙述正确的是( )
| A. | 与等量盐酸恰好中和时放出的热量:A=B | |
| B. | 与等量盐酸恰好中和时所得溶液的pH:A=B=C | |
| C. | a>10b | |
| D. | A和B相比,氨水A中$\frac{c(N{H}_{3}•{H}_{2}O)c({H}^{+})}{c(N{{H}_{4}}^{+})}$较小 |
7.化学与生活密切相关,下列叙述中不正确的是( )
| A. | 复方氢氧化铝有中和胃酸、解痉止痛的作用,胃痛、胃酸过多的患者可大量服用 | |
| B. | 食盐可作调味剂,也可作食品防腐剂 | |
| C. | 天然存在的动植物油脂几乎都是混合物,没有固定的熔沸点 | |
| D. | 硫化氢是空气污染物,有臭鸡蛋气味,有剧毒 |
4.常温常压下,气态三甲基硼在空气中能自燃,且能与HBr发生如下反应:HBr+B(CH3)3$→_{红外激光}^{10.3微米的}$B(CH3)2Br+CH4设NA为阿伏加德罗常数值.下列关于三甲基硼的说法,正确的是( )
| A. | 有强氧化性 | |
| B. | 1mol三甲基硼所含共价键数目为12NA | |
| C. | 与HBr发生加成反应 | |
| D. | 5.6g三甲基硼的体积为2.24L |
11.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 常温常压下6.0g乙酸所含σ键数目为0.8NA | |
| B. | 2.0gH218O与D2O的混合物中所含中子数为NA | |
| C. | 标准状况下,5.6LCO2与足量Na2O2反应转移的电子数为0.5NA | |
| D. | 50mLl2mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA |
1.设NA为阿佛加德罗常数的值,下列叙述正确的是( )
| A. | 11 g由31H和168O组成的超重水中,含有的中子数目为5 NA | |
| B. | 1 molN2与4 mol H2反应生成的NH3分子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1 mol氧气转移的电子数为0.2NA | |
| D. | 0.1L0.5mol/LCH3COOH溶液中含有的氢离子数为0.05NA |
8.有机物M、N、Q的转化关系为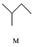 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$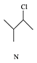 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$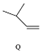 ,下列说法正确的是( )
,下列说法正确的是( )
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ ,下列说法正确的是( )
,下列说法正确的是( )| A. | M的名称为异丁烷 | |
| B. | N的同分异构体有7种(不考虑立体异构,不包括本身) | |
| C. | Q可与溴水反应生成N | |
| D. | M、N、Q均能使酸性KMnO4溶液褪色 |
20.青蒿素是一种有效的抗疟药.常温下,青蒿素为无色针状晶体,难溶于水,易溶于有机溶剂,熔点为156~157℃.提取青蒿素的方法之一是乙醚浸取法,提取流程如图1:
请回答下列问题:
(l)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ的名称是蒸馏.
(3)用图2实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

①仪器各接口的连接顺序从左到右依次为afgdebchi(每个装置限用一次).A装置中发生的化学反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O.
③装置D中的试剂为浓硫酸.
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如表:
则青蒿素的最简式为C15H22O5.
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是C(填字母代号).
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.
请回答下列问题:
(l)对青蒿进行破碎的目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸取率.
(2)操作I用到的玻璃仪器是漏斗、玻璃棒、烧杯,操作Ⅱ的名称是蒸馏.
(3)用图2实验装置测定青蒿素的化学式,将28.2g青蒿素放在燃烧管C中充分燃烧:

①仪器各接口的连接顺序从左到右依次为afgdebchi(每个装置限用一次).A装置中发生的化学反应方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
②装置C中CuO的作用是使青蒿素充分氧化生成CO2和H2O.
③装置D中的试剂为浓硫酸.
④已知青蒿素是烃的含氧衍生物,用合理连接后的装置进行实验.测量数据如表:
| 装置质量 | 实验前/g | 实验后/g |
| B | 22.6 | 42.4 |
| E(不含干燥管) | 80.2 | 146.2 |
(4)某学生对青蒿素的性质进行探究.将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解度较小,加热并搅拌,青蒿素的溶解度增大,且溶液红色变浅,与青蒿素化学性质相似的物质是C(填字母代号).
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖.

 .
.