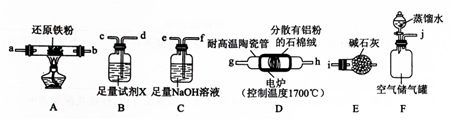
题目内容
14.常温下,下列各组离子在指定溶液中一定能大量共存的是( )| A. | 酸性溶液中:Mg2+、K+、SO42-、NO3- | |
| B. | 无色溶液中:Na+、A13+、NO3-、MnO4- | |
| C. | FeCl溶液中:Na+、NH4+、SCN-,SO42- | |
| D. | 与A1反应放出H2的溶液中:NH4+、Na+、NO3-、HCO3- |
分析 A.酸性溶液中该组离子之间不反应;
B.MnO4-为紫色;
C.离子之间结合生成络离子;
D.与A1反应放出H2的溶液,为非氧化性酸或强碱溶液.
解答 解:A.酸性溶液中该组离子之间不反应,可大量共存,故A选;
B.MnO4-为紫色,与无色不符,故B不选;
C.Fe3+、SCN-结合生成络离子,不能共存,故C不选;
D.与A1反应放出H2的溶液,为非氧化性酸或强碱溶液,碱溶液中不能大量存在NH4+、HCO3-,酸溶液中不能大量存在HCO3-,且酸溶液中Al、NO3-发生氧化还原反应不生成氢气,故D不选;
故选A.
点评 本题考查离子共存,为高频考点,把握习题中的信息及常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应的判断,题目难度不大.

练习册系列答案
相关题目
4.某烃结构式如图: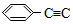 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )
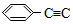 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 侧链所有碳原子可能共直线 | ||
| C. | 所有碳原子可能共面 | D. | 最多有18原子共面 |
2.下列说法不正确的是( )

| A. | 已知298K时氢氰酸(HCN)的Ka=4.9×10-10,碳酸的Ka1=4.4×10-7,Ka2=4.7×10-11,据此可推测将氢氰酸加入到碳酸钠溶液中不可能观察到有气泡产生 | |
| B. | 25℃时,将amol•L氨水与0.01mol•L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(CI-),用含a的代数式表示NH3•H2O的电离常数Kb=$\frac{1{0}^{-9}}{a-0.01}$ | |
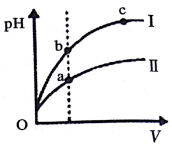
| C. | 某温度下,相同体积、相同pH的盐酸和醋酸溶液分别加水稀释,pH随溶液体积V变化的曲线如图所示.II为醋酸稀释时pH的变化曲线,且a、b两点水的电离程度:a<b | |
| D. | 向0.10mol•L-1NaHSO4溶液中通入NH3至溶液pH=7(通入气体对溶液体积的影响可忽略):c(Na+)>c(SO42-)>c(NH4+) |
9.二碳化学的研究在工业生产中具有重要意义.
(1)在一定温度和压强下,已知:
①CH3CH2OH(g)+$\frac{1}{2}$O2(g)?CH3CHO(g)+H2O(g)△H1=203kJ•mol-1.
②若2CH3CHO(g)+O2(g)?2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)?CH3COOH(g)+H2O(g)△H2 <0(填“>”、“<”或“=”).
(2 )将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)?2CH3CHO(g)+2H2O(g)至平衡状态.下列图象不合理的是B.

(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3•H2O)=1.75×10-5,$\sqrt{1.75}$≈1.3,lgl.3≈0.1
①25℃,0.lmol•L-1CH3COOH 溶液的pH=2.9;将0.1mol•L-1CH3COOH溶液与0.1mol•L-1的氨水等体积混合,所得溶液中离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-).
②25℃,0.2mol•L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=5.7×10-10 (保留2位有效数字).
③25℃,向0.1mol•L-1氨水中加入少量NH4Cl固体,NH3•H2O?NH4++OH-的电离平衡逆(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3•H2O是弱电解质取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅.证明NH3•H2O是弱电解质;.
(1)在一定温度和压强下,已知:
| 化学键 | C-H | C-O | O-H | C=O | O=O | C-C |
| 键能(kJ•mol-1) | 414 | 326 | 464 | 728 | 498 | 332 |
②若2CH3CHO(g)+O2(g)?2CH3COOH(g)反应可自发进行,
则CH3CH2OH(g)+O2(g)?CH3COOH(g)+H2O(g)△H2 <0(填“>”、“<”或“=”).
(2 )将一定量CH3CH2OH和O2充入恒温、恒压密闭容器中,发生反应2CH3CH2OH(g)+O2(g)?2CH3CHO(g)+2H2O(g)至平衡状态.下列图象不合理的是B.

(3)己知:25℃,Ka(CH3COOH)=1.75×10-5,Kb(NH3•H2O)=1.75×10-5,$\sqrt{1.75}$≈1.3,lgl.3≈0.1
①25℃,0.lmol•L-1CH3COOH 溶液的pH=2.9;将0.1mol•L-1CH3COOH溶液与0.1mol•L-1的氨水等体积混合,所得溶液中离子浓度大小关系为c(CH3COO-)=c(NH4+)>c(H+)=c(OH-).
②25℃,0.2mol•L-1NH4Cl溶液中NH4+水解反应的平衡常数Kh=5.7×10-10 (保留2位有效数字).
③25℃,向0.1mol•L-1氨水中加入少量NH4Cl固体,NH3•H2O?NH4++OH-的电离平衡逆(填“正”、“逆”或者“不”)移;请用氨水和某种铵盐(其它试剂与用品自选),设计一个实验证明NH3•H2O是弱电解质取少量氨水于试管中,滴加2~3滴酚酞试液,再加入少量醋酸铵固体,充分振荡后溶液红色变浅.证明NH3•H2O是弱电解质;.
19.下列离子方程式正确的是( )
| A. | 向FeCl3溶液中加入过量铁粉:Fe3++Fe═2Fe2+ | |
| B. | 铜溶于稀硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| C. | 向稀硫酸中加入 Ba(OH)2 溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+═H2SiO3↓+2Na+ |
3.下列离子方程式中,正确的是( )
| A. | 稀硫酸滴在铜片上:Cu+2H+═Cu2++H2O | |
| B. | 铁与稀盐酸混合:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 铜片插入硝酸银溶液中:Cu+2Ag+═Cu2++2Ag | |
| D. | 稀硝酸滴在石灰石上:CaCO3+2H+═Ca2++H2CO3 |