题目内容
17.第VA族元素按原子序数依次增大的顺序为氮(N)、磷(P)、砷(As)、锑(Sb)、铋(Bi).它们的单质及其化合物的应用较为广泛,请回答下列有关问题:(1)酸性:H3AsO4强于(填“强于”或“弱于”)H2Sb04.
(2)肼易溶于水,是一种二元弱碱,用电离方程式表示肼的水溶液显碱性的原因:N2H4+H2O
 N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).
N2H+5+OH-,25℃时水溶液中肼与强酸反应结合一个质子的平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$.常温下,若将2mol/LN2H4•H20溶液与1.3mol/L硫酸溶液等体积混合,则溶液中各微粒(离子及N2H4•H2O)浓度由大到小的顺序为c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-).(3)铋酸钠(NaBiO3)是一种难溶于水的固体,用于定性检验酸性溶液中Mn2+的存在(产物中铋元素以Bi3+形式存在),向硫酸锰溶液中加入足量铋酸钠固体后,溶液呈紫红色,反应的离子方程式为2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O,若向1L物质的量浓度均为2mol/L的硫酸与氯化锰的混合溶液中加入足量铋酸钠固体,反应所得氧化产物与还原产物的物质的量之比为1:1.
(4)酸碱电子理论认为,凡是可以接受电子对的物质称为酸,凡是可以提供电子对的物质称为碱.等物质的量的AsCl3、SbCl5、Cl2反应,可得一种离子化合物(氯元素只显-1价),阳离子为正四面体构型的一价阳离子,则阴离子的化学式为SbCl6-,反应中SbCl5表现的性质为酸性.
分析 (1)元素非金属性越强,最高价含氧酸的酸性越强;
(2)N2H4结合H2O电离的氢离子使溶液呈碱性;肼与强酸反应结合一个质子:N2H4+H+ N2H+5;将2mol/L N2H4•H2O溶液与1.3mol/L 硫酸溶液等体积混合,假设溶液体积均为1L,得到溶液中0.6mol N2H6SO4、(N2H5)2SO4为0.7mol,N2H5+、N2H62+水解,溶液呈酸性,水解程度微弱;
N2H+5;将2mol/L N2H4•H2O溶液与1.3mol/L 硫酸溶液等体积混合,假设溶液体积均为1L,得到溶液中0.6mol N2H6SO4、(N2H5)2SO4为0.7mol,N2H5+、N2H62+水解,溶液呈酸性,水解程度微弱;
(3)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;
先氧化氯离子为氯气,反应的离子方程式为:2Cl-+NaBiO3+6H+═Cl2↑+Bi3++Na++3H2O,再氧化锰离子为MnO4-,结合氢离子、氯离子、锰离子物质的量进行过量计算解答;
(4)反应中As元素被氧化为+5价,Cl还原Cl-,SbCl5中Sb的最外层的d轨道有空轨道,可以接受电子对形成SbCl6-离子,阳离子为正四面体构型的一价阳离为AsCl4+.
解答 解:(1)非金属性As>Sb,元素非金属性越强,最高价含氧酸的酸性越强,则酸性:H3AsO4 强于H2Sb04,
故答案为:强于;
(2)肼易溶于水,它是与氨类似的弱碱,则电离生成OH-和阳离子,电离方程式为N2H4+H2O N2H+5+OH-;肼与强酸反应结合一个质子:N2H4+H+
N2H+5+OH-;肼与强酸反应结合一个质子:N2H4+H+ N2H+5,则平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$;
N2H+5,则平衡常数Kb1=$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$;
将2mol/L N2H4•H2O溶液与1.3mol/L 硫酸溶液等体积混合,假设溶液体积均为1L,则N2H4•H2O为2mol、
H+为2.6mol,完全反应得到1mol(N2H5)2SO4后,剩余氢离子为2.6mol-2mol=0.6mol,则有0.3mol (N2H5)2SO4转化得到0.6mol N2H6SO4,故(N2H5)2SO4为0.7mol,N2H5+、N2H62+水解,溶液呈酸性,水解程度微弱,所以c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-),
故答案为:N2H4+H2O N2H+5+OH-;$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$;c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-);
N2H+5+OH-;$\frac{c({N}_{2}{{H}_{5}}^{+})}{c({N}_{2}{H}_{4})×c({H}^{+})}$;c(N2H5+)>c(SO4-)>c(N2H62+)>c(H+)>c(N2H4)>c(OH-);
(3)铋酸钠(不溶于水)在酸性溶液中与Mn2+反应生成MnO4-和Bi3+,则反应的离子方程式为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O,
氢离子为4mol、氯离子为4mol、锰离子为2mol,先氧化氯离子为氯气,
2Cl-+NaBiO3+6H+═Cl2↑+Bi3++Na++3H2O
4mol 12mol
故氢离子不足,只有部分氯离子被氧化,锰离子不反应,反应所得氧化产物(Cl2)与还原产物(Bi3+)的物质的量之比为 1:1,
故答案为:2Mn2++5NaBiO3+14H+═2MnO4-+5Bi3++5Na++7H2O;1:1;
(4)反应中As元素被氧化为+5价,Cl还原Cl-,SbCl5中Sb的最外层的d轨道有空轨道,可以接受电子对形成SbCl6-离子,阳离子为正四面体构型的一价阳离为AsCl4+,反应中SbCl5表现的性质为酸性,
故答案为:SbCl6-;酸.
点评 本题考查元素周期律应用、弱电解质的电离平衡、氧化还原反应、对信息的应用等,属于拼合型题目,侧重学生能力的考查,难度较大.

| A. | Na→Na2O2 | B. | SO2→S | C. | HCl→NaCl | D. | NaHCO3→CO2 |
| A. | v(NH3)=0.1mol•L-1•min-1 | B. | v(O2)=0.15mol•L-1•min-1 | ||
| C. | v(NO)=0.2mol•L-1•min-1 | D. | v(H2O)=0.25mol•L-1•min-1 |
| 选项 | 实验操作 | 现象 | 结论 |
| A | 某钾盐晶体中滴入浓盐酸,产生的气体通入品红溶液 | 品红溶液褪色 | 产生的气体一定是SO2 |
| B | 用磁铁吸引氧化铁与铝粉发生铝热反应后的黑色产物 | 能被磁铁吸引 | 黑色熔化物中含铁、四氧化三铁中的1种或2种 |
| C | 向某硫酸盐溶液中滴入酸性H2O2溶液,再滴入KSCN溶液 | 溶液变为红色 | 该硫酸盐一定为FeSO4 |
| D | 某品牌加碘食盐的溶液中,加入淀粉,并通入NO2 | 溶液变为蓝色 | 该加碘食盐中碘的存在形式为IO3- |
| A. | A | B. | B | C. | C | D. | D |
 CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
CaCO3与稀盐酸反应(放热反应),CaCO3+2HCl=CaCl2+CO2↑+H2O,生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )| A. | 反应开始2min内平均反应速率最大 | |
| B. | 可用c(Ca2+)或c(H+)的变化表示该反应速率 | |
| C. | 反应4min后平均反应速率减小 | |
| D. | 反应在第2min到第4min间生成CO2的平均反应速率为v${\;}_{C{O}_{2}}$=0.1mol/min |
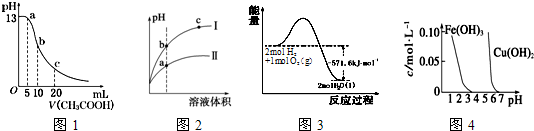
| A. | 图l表示常温下向体积为10mL0.1mol•L-1NaOH溶液中逐滴加入O.1mol•L-1CH3COOH液后溶液的pH变化曲线,则b点处有:c(CH3COOH)+c(H+)=c(OH-) | |
| B. | 图2表示用水稀释pH相同的盐酸和醋酸时溶液的pH变化曲线,其中I表示醋酸,II表示盐酸,且溶液导电性:c>b>a | |
| C. | 图3表示H2与O2发生反应过程中的能量变化,H2的燃烧热为285.8kJ.mol-1 | |
| D. | 由图4得出若除去CuSO4溶液中的Fe3+,可采用向溶掖中加入适量CuO,调节溶液的pH至4 |
 .
.
 .
. .
.