题目内容
13.实验室中用如图所示装置制取干燥的氨气,并完成喷泉实验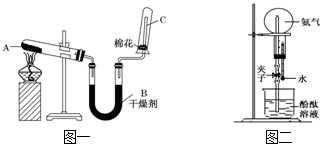
(1)写出A处发生反应的化学方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O.
(2)可选用碱石灰干燥剂干燥氨气.
(3)检验试管C中氨气是否集满,除用湿润的红色石蕊试纸外,还可采用哪种简易方法(简述操作、现象和结论)?玻璃棒蘸取浓盐酸,靠近试管口,若有大量白烟生成,说明试管C中已集满NH3
(4)用图二装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发喷泉的操作是打开止水夹,用手挤压胶头滴管,该实验的原理是内外形成较大的压强差,使大气压将水压进圆底烧瓶中.
分析 (1)实验室用氯化铵与氢氧化钙反应生成氨气、氯化钙和水制备氨气;
(2)氨气为碱性气体,应选择碱性气体;
(3)氨气与氯化氢反应生成白色固体;
(4)利用氨气极易溶于水,形成压强差而形成喷泉.
解答 解:(1)氯化铵与氢氧化钙反应生成氨气、氯化钙和水制备氨气,方程式:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
故答案为:2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O;
(2)氨气为碱性气体,应选择碱性干燥剂,碱石灰为碱性干燥剂,可以干燥氨气;
故答案为:碱石灰;
(3)氨气与氯化氢反应生成白色固体,检验氨气可以用玻璃棒蘸取浓盐酸,靠近试管口,若有大量白烟生成,说明试管C中已集满NH3;
故答案为:用玻璃棒蘸取浓盐酸,靠近试管口,若有大量白烟生成,说明试管C中已集满NH3;
(4)氨气极易溶于水,如果打开止水夹,氨气溶于水后烧瓶内压强迅速减小,内外形成较大的压强差,使大气压将水压进圆底烧瓶中而形成喷泉,
故答案为:打开止水夹,用手挤压胶头滴管; 内外形成较大的压强差,使大气压将水压进圆底烧瓶中.
点评 本题考查了氨气的制备和性质检验,明确氨气的制备原理和性质、喷泉实验的原理是解题关键,题目难度不大.

练习册系列答案
相关题目
1.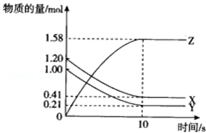 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
 一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )
一定温度下,在10L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的( )| A. | 反应开始10s时,X的物质的量浓度减少了0.79mol•L-1 | |
| B. | 反应的化学方程式为:2X(g)+2Y(g)═3Z(g) | |
| C. | 反应开始到10s时,已用去的Y占起始量的百分比21% | |
| D. | 反应进行到10s时已达到了平衡状态 |
8.骗子有时用铜锌合金制成假金币行骗.下列能有效鉴别其真假的是( )
| A. | 观察颜色 | B. | 滴一滴硝酸在币的表面,观察现象 | ||
| C. | 用手掂量轻重 | D. | 查看图案 |
18.下列离子反应方程式中,属于水解反应的是( )
| A. | NH4++H2O?NH3•H2O+H+ | B. | NH3•H2O?NH4++OH- | ||
| C. | HCO3-+H2O?H3O++CO32- | D. | 2Na2O2+2H2O═4NaOH+O2↑ |
2.某气体可能含有NH3、HCl、CO、H2、CO2中的一种或几种,在恒温恒压下将其通过浓硫酸时,总体积基本不变;再通过足量的澄清石灰水,未见浑浊,但总体积减小;把剩余气体导出后点燃,燃烧产物不能使无水硫酸铜变蓝.则原气体中一定有( )
| A. | CO和HCl | B. | H2,HCl和CO | C. | CO2,CO和HCl | D. | CO2,CO |
 、
、 、
、 .
.
 .
.