题目内容
14.下列有关物质结构的说法中,正确的是( )| A. | 用VSEPR理论预测BF3和NF3的立体构型均为平面三角形 | |
| B. | CO2是直线形分子,其中碳原子的杂化轨道类型为sp3杂化 | |
| C. | 电子层结构相同的简单离子,其半径随核电荷数增大而减小 | |
| D. | 在化学反应中,某元素由化合态变为游离态,则该元素一定被还原 |
分析 A.根据价层电子对互斥理论分析,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb);
B.CO2是直线形分子,碳原子的杂化轨道类型为sp杂化;
C.电子层结构相同的简单离子,其核电荷数越大,对核外电子的引力越强,半径越小;
D.某元素在化学反应中由游离态变为化合态,元素的化合价肯能升高,也可能降低.
解答 解:A.BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(a-xb)=$\frac{1}{2}$(3-3×1)=0,所以BF3分子的VSEPR模型是平面三角型,中心原子上没有孤对电子,所以其空间构型就是平面三角形;NF3分子的中心原子N原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(5-3×1)=1,所以NH3的VSEPR模型是四面体型,略去孤电子对后,其空间构型是三角锥形,故A错误;
B.二氧化碳分子结构简式为O=C=O,其中碳原子含有2个共价单键且不含孤电子对,所以碳原子为sp杂化,为直线形分子,故B错误;
C.电子层结构相同的简单离子,其核电荷数越大,对核外电子的引力越强,半径越小,则电子层结构相同的简单离子,其半径随核电荷数增大而减小,故C正确;
D.在化学反应中,某元素由化合态变为游离态,可能被还原,如Fe+Cu2+=Fe2++Cu,也可能被氧化,如Cl2+S2-=2Cl-+S,故D错误;
故选C.
点评 本题考查有关物质结构的知识,掌握杂化理论的应用、元素周期律、氧化还原有关知识是解答关键,题目难度不大.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目
5.温度一定时,在密闭容器中发生可逆反应:mA(g)+nB(g)?pC(g),达平衡后,若将混合气体的体积压缩到原来的一半.当再次达到平衡时,C的浓度为原来浓度的1.8倍,下列叙述中正确的是( )
| A. | 平衡向逆反应方向移动 | B. | 气体C的体积分数增大 | ||
| C. | m+n>p | D. | 气体A的转化率升高 |
9.下列有关物质结构的说法中,正确的是( )
| A. | CO2和SiO2都是直线形分子 | |
| B. | H2O和NH3的VSEPR模型不同 | |
| C. | 由分子构成的物质中一定含有共价键 | |
| D. | 形成共价键的元素不一定是非金属元素 |
19.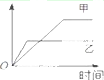 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( )
 表格中的各种情况,可以用如图的曲线表示的是( )
表格中的各种情况,可以用如图的曲线表示的是( ) | 反 应 | 纵坐标 | 甲 | 乙 | |
| A | 相同质量的氨,在同一容器中 2NH3═N2+3H2 △H<0 | 氨气的转化率 | 500℃ | 400℃ |
| B | 等质量钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| C | 向温度和压强都相同的甲乙两容器中分别投入体积比1:3的N2、H2(N2+3H2═2NH3) | 氨气的物质的量 | 反应过程中保持恒温恒容 | 反 应过程中保持恒温恒压 |
| D | 2molSO2和1molO2,在相同温度下 2SO2+O2═2SO3 | SO3 的浓度 | 2个大气压 | 10个大气压 |
| A. | A | B. | B | C. | C | D. | D |
3.钛铁矿的主要成分为FeTiO3(可表示为FeO•TiO2).用浓盐酸溶解钛铁矿去渣得溶液(含有Fe2+、TiOCl42-等),调节溶液的pH并加热,过滤得TiO2和滤液.控制反应温度在95℃左右,向滤液中加入H2O2和NH4H2PO4得到FePO4.再将FePO4与Li2CO3和H2C2O4一起煅烧,可制取LiFePO4.有关数据如下表所示:
(1)FeTiO3中Ti的化合价为+4,盐酸与FeTiO3反应的离子方程式为FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O.检验溶液中Fe2+的方法是先滴加KSCN溶液,不显血红色,再加入过氧化氢,溶液显血红色.
(2)为提高FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5
c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨做阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑.
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12Kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
(2)为提高FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5
c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2,则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨做阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑.
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12Kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
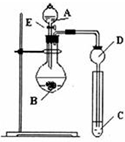 某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究.
某研究性学习小组设计了一组实验来探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置来一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用如图装置完成了O元素的非金属性比S强的实验研究. .
.