题目内容
17.如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容,据此判断下列说法错误的是( )
| A. | 该硫酸具有强烈的腐蚀性,应放于危险化学用品柜中妥善保管 | |
| B. | 取10mL该硫酸于烧杯中,再加18.4mL的水可配得9%的硫酸 | |
| C. | 配制200mL 4.6 mol/L的稀硫酸需取该硫酸50mL | |
| D. | 该硫酸与等质量的水混合所得溶液的物质的量浓度小于9.2mol/L |
分析 A.浓硫酸具有强的腐蚀性,为危险药品;
B.依据浓硫酸稀释方法解答;
C.依据溶液稀释过程中所含溶液中的物质量不变计算;
D.浓硫酸浓度越大其密度越大,硫酸密度大于水密度,等质量硫酸和水,水的体积大于硫酸体积.
解答 解:质量分数为98%、密度为1.84g/cm3的浓硫酸的物质的量浓度=$\frac{1000×1.84g/ml×98%}{98g/mol}$=18.4mol/L,为浓硫酸.
A.浓硫酸具有强的腐蚀性,为危险药品,应该妥善保管,故A正确;
B.浓硫酸稀释时,应将浓硫酸沿着烧杯壁缓缓注入水中,故B 错误;
C.因配制前后物质的量不变,则配制200ml4.6mol/L的稀硫酸需取该硫酸为$\frac{200×4.6}{18.4}$=50mL,故C正确;
D.浓硫酸浓度越大其密度越大,硫酸密度大于水密度,等质量硫酸和水,水的体积大于硫酸体积,所以二者混合后溶液体积大于浓硫酸的二倍,则其物质的量浓度小于原来的$\frac{1}{2}$,即小于9.2mol/L,故D正确;
故选B.
点评 本题考查物质的量浓度的有关计算,明确浓硫酸的性质及稀释操作是解题关键,注意浓硫酸浓度越大其密度越大,氨水浓度越大其密度越小,题目难度不大.

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
12.某离子化合物中,阳离子和阴离子的电子层结构与氖原子电子层结构相同,则此离子化合物化学式为( )
| A. | MgCl2 | B. | NaF | C. | MgO | D. | K2S |
12.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 1.6g由氧气和臭氧组成的混合物中含有氧原子数的数目为0.1NA | |
| B. | 1molFeI2与足量氯气反应时转移的电子数为2NA | |
| C. | 1mol Na2O2固体中含离子总数为4 NA | |
| D. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4 |
2.用下列试剂或方法不能鉴别NaCl溶液和KOH溶液的是( )
| A. | 无色酚酞试液 | B. | Ba(NO3)2溶液 | C. | CuCl2溶液 | D. | 焰色反应 |
9.国际无机化学命名委员会作出决定:把长式周期表原有的主、副族及族号取消,由左至右按原顺序改为18列,如碱金属为第一列,稀有气体为18列,按这个规定,下列说法中正确是( )
| A. | 第3列元素种类最多,第14列元素种类也最多 | |
| B. | 第8、9、10三列元素中没有非金属元素 | |
| C. | 从上到下第1列元素的单质熔点逐渐升高,第17列元素的单质熔点逐渐降低 | |
| D. | 只有第2列元素的原子最外层有2个电子 |
6.某一无色溶液,若向其中加入足量饱和氯水,溶液呈橙色;再向橙色溶液中滴加BaCl2溶液,产生白色沉淀;若向原溶液中加入铝粉,有气体放出.该溶液可能大量存在的一组离子是( )
| A. | K+、Br-、CO32-、OH- | B. | H+、Br-、ClO-、SO42-、Na+ | ||
| C. | SO42-、Br-、H+、Fe3+ | D. | Br-、SO32-、OH-、K+ |
7.柠檬烯具有特殊香气.可溶于乙醇或乙醚,不溶于水,其结构简式如图所示:
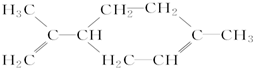
有关柠檬烯的说法正确的是( )

有关柠檬烯的说法正确的是( )
| A. | 柠檬烯的分子式为C10H16,能使溴的四氯化碳溶液褪色 | |
| B. | 柠檬烯分子为非极性分子 | |
| C. | 柠檬烯分子中所有碳原子处于同一个平面上 | |
| D. | 柠檬烯能与酸性高锰酸钾溶液发生取代反应 |
 .
.