题目内容
13.下列物质中,物质的量最大的是A,摩尔质量最大的是D,标准状况下体积最大的是A,含氢原子个数最多的是A,质量最大的是D.A.6g H2 B.0.8mol CH4 C.1.204×1024个H2S分子 D.147g H3PO4E.27mL水.
分析 根据n=$\frac{m}{M}$计算6g H2的物质的量,根据n=$\frac{N}{{N}_{A}}$计算H2S的物质的量,n=$\frac{m}{M}$计算147g H3PO4的物质的量,根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量;
根据V=nVm可知,气体的物质的量越大,体积越大,磷酸与水时液体,相同物质的量体积远远小于气体;
氢气中氢原子物质的量是氢气的2倍,CH4中原子的物质的量是CH4的4倍,硫化氢中原子的物质的量是硫化氢的3倍,磷酸中原子的物质的量磷酸分子的8倍,水中原子的物质的量是水的3倍,据此计算判断;
根据m=nM计算气体的质量,据m=ρV计算水的质量,据此据此判断.
解答 解:A、6g H2的物质的量为$\frac{6g}{2g/mol}$=3mol,
B、0.8mol CH4,
C、H2S的物质的量为$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,
D、147g H3PO4的物质的量为$\frac{147g}{98g/mol}$=1.5mol,
E、水的质量为27mL×1g/mL=27g,水的物质的量为$\frac{27g}{18g/mol}$=1.5mol;
故物质的量最大的是:6g H2;
摩尔质量最大的是磷酸;
磷酸与水时液体,相同物质的量体积远远小于气体,根据V=nVm可知,气体的物质的量越大,体积越大,故体积最大的是6g H2;
氢气中含有原子为3mol×2=6mol,CH4中含有原子为0.8mol×4=3.2mol,硫化氢中含有原子为2mol×2=4mol;
氢气的质量6g,CO2的质量为0.8mol×44g/mol=35.2g,硫化氢的质量为2mol×34g/mol=68g,磷酸的质量147g,水的质量为为27mL×1g/mL=27g,故质量最大的是:147g H3PO4,
故答案为:A;D; A;A; D.
点评 考查常用化学计量的有关计算,比较基础,注意对公式的理解与运用,注意基础知识的理解掌握.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | 向石灰水中通入过量CO2 | |
| B. | 向Fe(OH)3胶体中逐滴加入过量H2SO4溶液 | |
| C. | 足量NaOH溶液中逐滴加入Al2(SO4)3溶液 | |
| D. | 向NaAlO2溶液中逐滴加入盐酸至过量 |
| X | Y | Q | ||
| Z | W |
| A. | 形成简单离子的半径大小顺序:r(W)>r(Z)>r(Y) | |
| B. | 最简单气态氢化物的热稳定性:Y>X | |
| C. | Q的氢化物的水溶液可用于蚀刻玻璃 | |
| D. | X、Z的最高价氧化物均可与NaOH溶液反应 |
| A. | 质子数为53、中子数为78的碘原子:${\;}_{53}^{131}$I | |
| B. | 硫离子的结构示意图: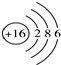 | |
| C. | H2O2的结构式:H-O-H-O | |
| D. | NH4I的电子式: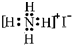 |
| A. | Fe2O3 | B. | FeO | C. | Fe(OH)3 | D. | Fe3O4 |
| A. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| B. | 不法商家制取的“地沟油”具有固定的熔沸点 | |
| C. | 钢铁制品和铜制品既能发生吸氧腐蚀又能发生析氢腐蚀 | |
| D. | 在家可用食醋代替CO2来增强漂白粉的漂白性 |
