题目内容
测定某种气体分子式的两个方法是:
(1)取20mL该气体,施以电火花使之完全分解为40mL气体(体积是在同温、同压下测定的.下同).通入20mL O2,施以电火花,生成的H2O被吸收后,气体体积为15mL,又经脱O2后,剩余气体体积为10mL(N2).请给出该气体的分子式
(2)把该气体的水溶液(浓)加到体积为V的Cl2中,剧烈反应,并冷却原温度后,把原先盛Cl2的容器倒置于水中,水即进入容器,残余气体体积为
V.请解释原因并给出必要的反应方程式 .
(1)取20mL该气体,施以电火花使之完全分解为40mL气体(体积是在同温、同压下测定的.下同).通入20mL O2,施以电火花,生成的H2O被吸收后,气体体积为15mL,又经脱O2后,剩余气体体积为10mL(N2).请给出该气体的分子式
(2)把该气体的水溶液(浓)加到体积为V的Cl2中,剧烈反应,并冷却原温度后,把原先盛Cl2的容器倒置于水中,水即进入容器,残余气体体积为
| 1 |
| 3 |
考点:化学方程式的有关计算
专题:计算题
分析:(1)由元素守恒可知,气体分解得到氢气、氮气,生成氮气为10mL,则生成氢气为30mL,相同条件下体积之比等于物质的量之比,结合原子守恒确定该气体分子式;
(2)残余气体体积为
V,是N2体积,表明NH3能和V Cl2反应生成
V体积的 N2,发生反应:2 NH3+3 Cl2=N2+6 HCl,且生成物中HCl易溶于水.
(2)残余气体体积为
| 1 |
| 3 |
| 1 |
| 3 |
解答:
解:(1)由元素守恒可知,气体分解得到氢气、氮气,生成氮气为10mL,则生成氢气为30mL,相同条件下体积之比等于物质的量之比,故气体、氮气、氢气的物质的量之比为2:1:3,反应可以表示2A=N2+3H2,故该气体分子式为:NH3,
故答案为:NH3;
(2)残余气体体积为
V,是N2体积,表明NH3能和V Cl2反应生成
V体积的 N2,发生反应:2 NH3+3Cl2=N2+6 HCl,且生成物中HCl易溶于水,
故答案为:残余气体体积为
V,是N2体积,表明NH3能和V Cl2反应生成
V体积的 N2,发生反应:2 NH3+3Cl2=N2+6 HCl,且生成物中HCl易溶于水.
故答案为:NH3;
(2)残余气体体积为
| 1 |
| 3 |
| 1 |
| 3 |
故答案为:残余气体体积为
| 1 |
| 3 |
| 1 |
| 3 |
点评:本题考查化学方程式计算等,难度中等,是对学生综合能力的考查.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
Se是人体必需微量元素,下列关于
Se和
Se说法正确的是( )
78 34 |
80 34 |
A、
| ||||
B、
| ||||
C、
| ||||
D、
|
物质的量为0.10mol的镁条在只含有CO2和O2混合气体的容器中燃烧(产物不含碳酸镁),反应后容器内固体物质的质量不可能为( )
| A、3.2 g |
| B、4.0 g |
| C、4.2 g |
| D、4.6 g |
下面有机物的同系物中,完全燃烧产生的水和二氧化碳的物质的量之比恒定的:( )
(a)饱和一元醇,
(b)饱和一元醛,
(c)饱和一元羧酸,
(d)饱和一元醇和饱和一元羧酸生成的酯,
(e)乙炔的同系物,
(f)苯的同系物.
(a)饱和一元醇,
(b)饱和一元醛,
(c)饱和一元羧酸,
(d)饱和一元醇和饱和一元羧酸生成的酯,
(e)乙炔的同系物,
(f)苯的同系物.
| A、(b)(c) |
| B、(a)(d) |
| C、(b)(c)(d) |
| D、(b)(c)(d)(e)(f) |
下列物质分离的方法中不正确的是( )
| A、石油经蒸馏分离成为汽油、煤油和柴油等产品是利用了物质的沸点不同 |
| B、硝酸钾和氯化钾浓溶液降温结晶得到硝酸钾晶体是利用了它们的溶解度随温度变化不同 |
| C、使用酒精可以将溶解于水中的碘萃取出来 |
| D、沙里淘金是利用了物质的密度不同,从而达到提取黄金的目的 |
在KBr和KI混合溶液中,通入足量的氯气,反应后蒸干溶液、灼烧,残留物是( )
| A、KCl |
| B、KCl和KBr |
| C、KCl和KI |
| D、KCl、Br2和I2 |
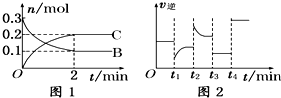 一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )
一定温度下,在2L的密闭容器中发生如下反应:A(s)+2B(g)?2C(g)△H<0,反应过程中B、C的物质的量随时间变化的关系如图1;反应达平衡后在t1、t2、t3、t4时分别都只改变了一种条件,逆反应速率随时间变化的关系如图2.下列有关说法正确的是( )| A、t1时改变的条件可能是升高温度 |
| B、t2时改变的条件可能是增大B的浓度 |
| C、t3时改变的条件可能是加压,此时c(B)不变 |
| D、t4时可能是使用了催化剂,此时c(B)不变 |