题目内容
NA为阿伏加德罗常数,下列物质的物质的量最小的是( )
| A、含NA个氧原子的O2 |
| B、标准状况下2.24LN2 |
| C、0.5molCH4 |
| D、22gCO2(CO2摩尔质量为44g?mol-1) |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据n
计算物质的量,结合分子式计算氧气物质的量;
B、依据n=
计算氮气物质的量;
C、甲烷物质的量为0.5mol;
D、依据n
计算物质的量;
| N |
| NA |
B、依据n=
| V |
| Vm |
C、甲烷物质的量为0.5mol;
D、依据n
| m |
| M |
解答:
解:A、氧原子物质的量依据n=
计算物质的量,n=
=1mol,结合分子式计算氧气物质的量为0.5mol;
B、依据n=
计算氮气物质的量=
=0.1mol;
C、甲烷物质的量为0.5mol;
D、依据n
计算物质的量=
=0.5mol;
综上所述标准状况下2.24LN2,物质的量最小;
故选B.
| N |
| NA |
| NA |
| NA |
B、依据n=
| V |
| Vm |
| 2.24L |
| 22.4L/mol |
C、甲烷物质的量为0.5mol;
D、依据n
| m |
| M |
| 22g |
| 44g/mol |
综上所述标准状况下2.24LN2,物质的量最小;
故选B.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是物质的量和质量、气体体积、微粒数等物理量的定量计算分析.掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
互为同素异形体的是( )
A、
| ||||
| B、CH4与C2H6 | ||||
| C、正丁烷与异丁烷 | ||||
| D、红磷与白磷 |
甲、乙、丙、丁4种无机化合物均含有2种元素,分子中均含18个电子.甲是气态氢化物,在水中分步电离出两种阴离子.下列推断合理的是( )
| A、某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B、乙和甲中同种元素的质量分数相等,则乙能使湿润的KI淀粉试纸变蓝 |
| C、丙中含有ⅣA族元素,则相同条件下丙比甲稳定 |
| D、若丁的分子组成符合XY3型结构,则丁分子间存在氢键 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、加入KSCN溶液显红色的溶液:K+、NH4+、Cl-、NO3- | ||
B、常温下,
| ||
| C、滴入酚酞试液显红色的溶液:Mg2+、Al3+、Br-、SO42- | ||
| D、能溶解Al2O3的溶液:Na+、Ca2+、HCO3-、NO3- |
500mL NaNO3和Cu(NO3)2的混合溶液中c(NO3-)=0.3mol?L-1,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到气体1.12L(标准状况下),假定电解后溶液体积仍为500mL,下列说法正确的是( )
| A、原混合溶液中c(Na+)=0.2mol?L-1 |
| B、电解后溶液中c(H+)=0.2mol?L-1 |
| C、上述电解过程中共转移0.4mol电子 |
| D、电解后得到的Cu的物质的量为0.1mol |
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A、电解食盐水若产生2g氢气,则转移的电子数目为2NA |
| B、200mL 1mol/L Al2(SO4)3溶液中,Al3+和SO42-总数为NA |
| C、在标准状况下,含4n mol HCl浓盐酸与足量的MnO2反应生成Cl2分子的个数等于nNA |
| D、6g金刚石所含碳碳键数为2NA |
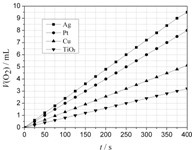 某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题:
某些金属及金属氧化物对H2O2的分解反应具有催化作用,请回答下列问题: