题目内容
下列各项中,电离方程式正确的是( )
| A、HCO3-+H2O═CO32-+H3O + |
| B、H2SO3=2H++SO32- |
| C、NaHCO3═Na++HCO3- |
| D、NaHSO4(熔融)=Na++H++SO42- |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:强电解质在溶液中能完全电离,弱电解质则部分电离,离子团在电离方程式中不能拆开,强酸的酸式根离子要拆开,弱酸的酸式根离子不要拆开.
解答:
解:A、碳酸氢根离子电离出碳酸根离子和氢离子,氢离子以水合氢离子存在,即HCO3-+H2O═CO32-+H3O+,故A正确;
B、亚硫酸是弱酸,要分步电离,电离方程式为:H2SO3=H++HSO3-,HSO3-=2H++SO32-,故B错误;
C、碳酸氢钠是强电解质,能完全电离出钠离子和碳酸氢根离子,即NaHCO3═Na++HCO3-,故C正确;
D、硫酸氢钠在熔融态时电离出两种离子,即NaHSO4(熔融)=Na++HSO4-,故D错误.
故选AC.
B、亚硫酸是弱酸,要分步电离,电离方程式为:H2SO3=H++HSO3-,HSO3-=2H++SO32-,故B错误;
C、碳酸氢钠是强电解质,能完全电离出钠离子和碳酸氢根离子,即NaHCO3═Na++HCO3-,故C正确;
D、硫酸氢钠在熔融态时电离出两种离子,即NaHSO4(熔融)=Na++HSO4-,故D错误.
故选AC.
点评:本题考查了电离方程式的书写正误,掌握电离方程式的书写方法并能灵活运用是正确解答此类题的关键,题目难度不大.

练习册系列答案
相关题目
下列物质中,常温下能反应产生气体的是( )
| A、浓硫酸和铜 |
| B、稀硫酸和铜 |
| C、浓硝酸和铁 |
| D、稀硫酸和铝 |
已知阿伏加德罗常数的值为 NA,下列说法正确的是( )
| A、2 mol H2O 含有NA个水分子 |
| B、1 g氢气含有NA个H2 |
| C、1 mol Zn与过量稀盐酸反应生成 NA个氢气分子 |
| D、32 g CH4 中含有 5 NA个原子 |
下列物质中,能与Fe3+反应,且能证明Fe3+具有氧化性的是( )
①SCN-;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH-.
①SCN-;②Fe;③Fe2+;④Cu;⑤Zn;⑥OH-.
| A、①②③ | B、②④⑤ |
| C、①③⑥ | D、①②⑤ |
分类法是一种行之有效、简单易行的科学方法,人们在认识事物时可以采取多种分类方法.下列关于NaHCO3的分类正确的是( )
| A、酸 | B、氧化物 | C、有机物 | D、钠盐 |
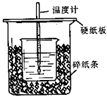 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: