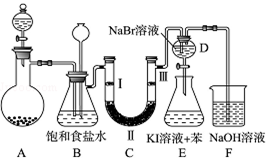
题目内容
9.氧是地壳中含量最多的元素.(1)氧元素基态原子核外未成对电子数为2个.
(2)①H2O分子内的O-H键、②分子间的范德华力和③氢键从强到弱依次为(填序号即可)①>③>②.
(3)对羟基苯甲醛的沸点比邻羟基苯甲醛高,理由是
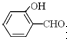 形成分子内氢键,而
形成分子内氢键,而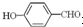 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.(4)H+可与H2O形成H3O+,H3O+中O原子采用sp3杂化轨道.H3O+中H-O-H键角比H2O中H-O-H键角大,原因为H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
分析 (1)O元素原子核外有8个电子,其2p轨道上有4个电子,分别位于3个轨道上;
(2)作用力:化学键>氢键>分子间作用力;
(3)分子间氢键的作用力大于分子内氢键的作用力;
(4)H3O+中O原子价层电子对个数=3+$\frac{6-1-3×1}{2}$=4,根据价层电子对互斥理论判断O原子杂化方式;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力.
解答 解:(1)O元素原子核外有8个电子,其2p轨道上有4个电子,分别位于3个轨道上,所以氧元素基态原子核外未成对电子数为2个,故答案为:2;
(2)共价键的键能大于氢键的作用力,氢键的作用力还大于范德华力,故H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为①>③>②,故答案为:①>③>②;
(3)含分子间氢键的物质的沸点大于分子内氢键物质的沸点,因此原因是前者易形成分子间氢键,后者易形成分子内氢键,
故答案为: 形成分子内氢键,而
形成分子内氢键,而 形成分子间氢键,分子间氢键使分子间作用力增大;
形成分子间氢键,分子间氢键使分子间作用力增大;
(4)H3O+中O原子价层电子对个数=3+$\frac{6-1-3×1}{2}$=4,根据价层电子对互斥理论判断O原子采用sp3杂化;一般来说,相互之间排斥力的大小为:孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,因为孤电子对间的排斥力>孤电子对与成键电子对间的排斥力>成键电子对间的排斥力,导致H3O+中H-O-H键角比H2O中H-O-H键角大,
故答案为:sp3;H2O中O原子有两对孤对电子,H3O+中O原子有一对孤对电子,排斥力较小.
点评 本题考查原子杂化、氢键、原子核外电子排布等知识点,侧重考查学生分析判断及计算能力,难点是价层电子对个数的计算方法,注意:氢键不属于化学键,属于分子间作用力,题目难度不大.

| 成分 | 质量(g) | 摩尔质量(g•mol-1) |
| 蔗糖 | 25.00 | 342 |
| 硫酸钾 | 0.87 | 174 |
| 阿司匹林 | 0.17 | 180 |
| 高锰酸钾 | 0.316 | 158 |
| 硝酸银 | 0.075 | 170 |
A.蔗糖 B.硫酸钾 C.高锰酸钾 D.硝酸银
(2)为配制500mL上述“鲜花保鲜剂”所需的玻璃仪器有:烧杯、玻璃棒、量筒、500mL容量瓶、胶头滴管.(在横线上填写相应仪器的名称),
(3)某同学取用保鲜剂固体配制溶液的过程如图所示,其错误操作序号是①⑤
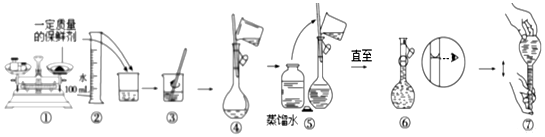
(4)在溶液配制过程中,下列实验操作会使配得的溶液浓度偏大的是AC.
A.溶解固体时,未冷却就直接转移
B.转移溶液后未洗涤烧杯和玻璃棒就直接定容
C.在容量瓶中定容时俯视刻度线
D.定容后把容量瓶倒转摇匀,发现液面低于刻度,再补充几滴水至刻度.
| A. | H2在Cl2中燃烧 | B. | 酸碱中和反应 | ||
| C. | 液态水变成水蒸气 | D. | 浓硫酸稀释 |