题目内容
19.冬天使用的热敷袋里面有铁粉、氯化钠、碳粉,利用铁被氧化放出的热量取暖.某同学拆开一袋后取里面的固体粉末进行实验:①将粉末投入盛有足量稀盐酸的烧杯中,观察到有大量气泡产生,底部有黑色粉末.则发生反应的离子方程式为Fe+2H+=Fe2++H2↑.
②为分离出反应后的溶液,可将上述烧杯中混合物进行过滤操作,该操作需要的玻璃仪器为烧杯、玻璃棒和漏斗.
③在②得到的溶液中通入氯气,发生如下离子反应:2Fe2++Cl2=2Fe3++2Cl─;在该离子方程式中,当有ag氧化产物生成时,需通入标准状况下的氯气体积为0.2aL(用含a的代数式表示).
④该同学将少量铜片投入制得的含FeCl3的溶液中,发现铜片慢慢溶解消失,溶液由黄色变为青绿色.则发生反应的离子方程式为2Fe3++Cu=Cu2++2Fe2+.
分析 ①Fe和稀盐酸反应生成氯化亚铁和氢气,所以有大量气泡生成,底部黑色粉末是铁粉;
②难溶性固体和溶液采用过滤方法分离;根据过滤操作所需仪器选取仪器;
③该反应中氧化产物是铁离子,根据铁离子和氯气之间的关系式计算消耗氯气体积;
④铜和氯化铁反应生成氯化亚铁和铜离子.
解答 解:①Fe和稀盐酸反应生成氯化亚铁和氢气,所以有大量气泡生成,底部黑色粉末是铁粉,离子方程式为Fe+2H+=Fe2++H2↑,
故答案为:Fe+2H+=Fe2++H2↑;
②难溶性固体和溶液采用过滤方法分离,氯化亚铁易溶于水,C不易溶于水,所以分离氯化亚铁和碳采用过滤方法;过滤操作用到的玻璃仪器有烧杯、玻璃棒、漏斗,
故答案为:过滤;烧杯、玻璃棒和漏斗;
③该反应中氧化产物是铁离子,设消耗氯气体积为V,
2Fe2++Cl2=2Fe3++2Cl─;
22.4L 112g
V ag
22:4L:112g=V:ag
V=$\frac{22.4L×ag}{112g}$=0.2aL,
故答案为:0.2a;
④铜和氯化铁反应生成氯化亚铁和铜离子,离子方程式为 2Fe3++Cu=Cu2++2Fe2+,
故答案为:2Fe3++Cu=Cu2++2Fe2+.
点评 本题考查离子方程式书写、化学方程式计算、物质分离提纯等知识点,侧重考查学生分析判断计算能力,明确元素化合物性质、各物质之间的关系水解本题关键,题目难度不大.

练习册系列答案
相关题目
4.下列电子排布式中不正确的是( )
| A. | 1s22s22p63s23p63d104s1 | B. | 1s22s22p63s23p63d64s2 | ||
| C. | 1s22s22p63s23p63d34s2 | D. | 1s22s22p63s23p63d44s2 |
11.某溶液中含有Ag+、Cu2+、Mg2+、Ba2+、Al3+等离子,要使这些离子逐一沉淀分离,所加试剂及顺序正确的是( )
| A. | H2SO4→HCl→K2S→NaOH→CO2 | B. | NaCl→Na2SO4→Na2S→NH3•H2O→HCl | ||
| C. | Na2S→Na2SO4→NaCl→NaOH→HCl | D. | NaCl→Na2SO4→H2S→NaOH→CO2 |
8.25℃时,PH=11的NaOH溶液和NaCN溶液中,由水电离出的c(OH-)的关系( )
| A. | 相等 | B. | 后者是前者的11倍 | ||
| C. | 后者是前者的108 | D. | 前者是后者的108 |
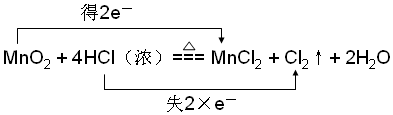 .
. 在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①-⑤中适当的物质,使有连线的两种物质能发生反应.
在稀硫酸、二氧化碳、铜片、食盐、生石灰、一氧化碳、纯碱、铁片和木炭粉9种物质间存在下面的相互关系,选择①-⑤中适当的物质,使有连线的两种物质能发生反应.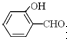 形成分子内氢键,而
形成分子内氢键,而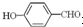 形成分子间氢键,分子间氢键使分子间作用力增大.
形成分子间氢键,分子间氢键使分子间作用力增大.