题目内容
7.下列烧杯中盛放的都是稀硫酸,能构成原电池的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 根据原电池的构成条件判断;
原电池的构成条件为:
1、活泼性不同的两个电极;
2、电解质溶液;
3、形成闭合回路;
4、能自发进行氧化还原反应.
解答 解:A、B、C都符合原电池的构成条件,所以都是原电池;D装置没有形成闭合回路,所以不能构成原电池.
故选D.
点评 原电池的构成条件为:1、活泼性不同的两个电极;2、电解质溶液;3、形成闭合回路;4、能自发进行氧化还原反应,理解原电池的构成条件是解本题的关键,难度较小.

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
6.下列关于能源和作为能源使用的物质的叙述中,错误的是( )
| A. | 化石燃料蕴藏的能量来自远古时期生物体所吸收利用的太阳能 | |
| B. | 太阳能不能直接转化为电能 | |
| C. | 物质的化学能可以在不同条件下转化为热能、电能等为人类所用 | |
| D. | 绿色植物发生光合作用时,将太阳能转化为化学能“贮存”起来 |
2.下列过程属于人工固氮的是( )
| A. | 用N2和H2合成NH3 | B. | 闪电时大气中氮的氧化物的生成 | ||
| C. | 由氨制尿素 | D. | 从空气中分离出氮气 |
12.下列物质中含有非极性共价键的离子化合物是( )
| A. | Cl2 | B. | Na2O2 | C. | H2O2 | D. | MgCl2 |
19.下列热化学方程式书写正确的是(△H的绝对值均正确)( )
| A. | C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) | |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=+57.3 kJ/mol(中和热) | |
| C. | S(s)+O2(g)═SO2(g);△H=-296.8 kJ/mol(反应热) | |
| D. | 2NO2═O2+2NO;△H=116.2 kJ/mol(反应热) |
16.将如图所示实验装置的 K 闭合,下列判断正确的是( )
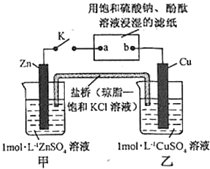

| A. | Cu 电极上发生还原反应 | B. | 电子沿 Zn→a→b→Cu 路径流动 | ||
| C. | 片刻后甲池中 c(SO42-)增大 | D. | 片刻后可观察到滤纸 b 点变红色 |
17.下列表示物质结构的化学用语或模型正确的是( )
| A. | (CH3)3COH的名称:2,2二甲基乙醇 | B. | 乙醛的结构式:CH3CHO | ||
| C. | CH4分子的比例模型: | D. | 丙烯分子的结构简式为 CH3CHCH2 |
 CH4、NH3、H2O和HF均为含10e-的分子.
CH4、NH3、H2O和HF均为含10e-的分子.
 .
.