题目内容
1.某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验.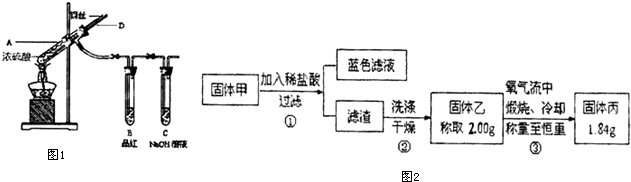
[实验1]铜与浓硫酸反应,实验装置如图1所示.
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;③将Cu丝上提离开液面.
(1)装置A中发生反应的化学方程式为2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O.
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是试管A中气体压强减小,空气从D导管进入试管A中
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中通入空气(鼓气).
[实验2]实验中发现试管内除了产生白色固体外,在铜丝表面还产生黑色固体甲,其中可能含有氧化铜、硫化铜、硫化亚铜,以及被掩蔽的氧化亚铜.
查阅资料:①氧化亚铜在酸性环境下会发生自身氧化还原反应生成Cu2+和铜单质,在氧气流中煅烧,可以转化为氧化铜.②硫化铜和硫化亚铜常温下都不溶于稀盐酸,在氧气流中煅烧,硫化铜和硫化亚铜都转化为氧化铜和二氧化硫.
为了研究甲的成分,该小组同学在收集到足够量的固体甲后,进行了如图2的实验:
(4)②中检验滤渣是否洗涤干净的实验方法是取最后一次洗涤后所得液体,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净,若有白色沉淀生成,则说明未洗干净
(5)③中在煅烧过程中一定发生的反应的化学方程式为2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2.
分析 (1)装置A中铜与浓硫酸反应生成硫酸铜、二氧化硫气体和水,据此写出反应的化学方程式;
(2)导管D起到了平衡A中大气压的作用,当熄灭酒精灯后,空气从导管D中进入,使试管中压强与大气压相等;
(3)从D管口向A中大量鼓气可使装置中残留气体完全被吸收;
(4)检验滤渣是否洗涤干净的实验方法是取最后一次洗涤后所得液体少许于试管中,滴加硝酸银溶液观察是否有沉淀生成;
(5)根据反应:Cu+O2=CuO;Cu2S+2O2=2CuO+2SO2;2CuS+3O2=2CuO+2SO2;从质量变化的角度分析.
解答 解:(1)装置A中铜与浓硫酸反应生成二氧化硫气体,反应的化学方程式为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O;SO2+2OH-=SO32-+H2O;
(2)熄灭酒精灯后,试管A中气体压强减小,空气从D导管进入试管A中,从而使A中压强与大气压相等,所以B中的液体不会倒吸,
故答案为:试管A中气体压强减小,空气从D导管进入试管A中;
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是从D管口向A中大量鼓气,
故答案为:从D管口向A中通入空气(鼓气);
(4)检验滤渣是否洗涤干净的实验方法是取最后一次洗涤后所得液体少许于试管中,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净,若有白色沉淀生成,则说明未洗干净,
故答案为:取最后一次洗涤后所得液体,滴加硝酸银溶液,若无白色沉淀产生,则说明沉淀洗涤干净,若有白色沉淀生成,则说明未洗干净;
(5)根据反应判断:Cu+O2=CuO 反应后固体质量增重,Cu2S+2O2=2CuO+2SO2反应后固体质量不变,2CuS+3O2=2CuO+2SO2反应后固体质量减重,则一定存在的反应为:2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2,
故答案为:2CuS+3O2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2.
点评 本题考查浓硫酸的性质,题目难度中等,试题整合和拓展了教材中的典型实验,侧重基本实验操作能力考查,注意掌握常见气体的制备、除杂、收集、尾气处理等基本操作,熟悉教材中的典型实验装置.

 A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:
A~E五种元素均位于周期表的前四周期,有关它们的信息如下表所示:回答下列问题
| 元素 | 相关信息 |
| A | 元素A是周期表中原子半径最小的元素 |
| B | B的单质由双原子分子构成,分子中有14个电子 |
| C | C3单质在大气层的平流层中,其浓度的减少会导致人患皮肤癌 |
| D | D是前四周期元素中第一电离能最小的元素 |
| E | E位于ds区且原子的最外层电子数与A相同 |
(1)C元素基态原子的价电子排布图为

(2)[E(A2C)4]2+中E2+与A2C间的作用为B(填字母编号
A.离子键 B.配位键 C.金属键 D.分子间作用力
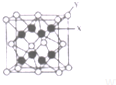
(3)D2C的晶胞结构与CaF2晶胞(如图)相似,则X应为K+
D2C的熔点比CaF2的熔点低(填“高”、“低”、“无法比较”)
(4)与B2C互为等电子体分子为CO2,其分子的立体构型为直线型
(5)已知:A2(g)+$\frac{1}{2}$C2(g)=A2C(g)△H1=-akJ/mol
B2(g)+3A2(g)=2BA3(g)△H2=-bkJ/mol
则34gBA3(g)与C2(g)反应生成B2(g)与A2C(g)时,该反应的热化学反应方程式为2NH3(g)+$\frac{3}{2}$O2(g)=N2(g)+3H2O(g)△H=(b-3a)kJ/mol.
| 序号 | 实验目的 | 实验设计 |
| A | 证明CH2═CHCHO中含有碳碳双键 | 滴入KMnO4酸性溶液,看紫红色是否褪去 |
| B | 鉴别碳酸钠溶液与碳酸氢钠溶液 | 分别加入少量的氢氧化钠溶液,观察现象 |
| C | 实验室制取少量O2气体 | 将蒸馏水滴入过氧化钠固体中,用排水法收集产生的气体 |
| D | 除去硫酸铜溶液中少量的硫酸铁 | 加入过量铜粉,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
(1)上述条件下该反应能够自发进行,则反应的△H<0(填写“>”、“<”、“=”).
(2)能判断该反应达到化学平衡状态的依据是AB.
A.混合气体的压强保持不变
B.N2的浓度不再改变
C.消耗CO的物质的量与生成CO2的物质的量之比为1:1
D.NO、CO、CO2、N2的物质的量之比为2:2:2:1
(3)既要加快反应速率又要提高NO转化率,下列措施可行的是D.
A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的体积
(4)为了测定在某种催化剂作用下的反应速率,某科学家在某温度下用气体传感器测得不同时间的NO和CO浓度如表(均不考虑温度变化对催化剂催化效率的影响):
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO)( mol•L-1) | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)( mol•L-1) | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | c | 2.70×10-3 |
①c=2.70×10-3mol•L-1;
②前2s内的平均反应速率v(N2)=1.875×10-4mol/(L.s);
③该温度下反应的平衡常数K=5×103.
| A. | 氢氧化铯碱性强于氢氧化钠 | |
| B. | 碱金属单质从Li到Cs,熔点依次升高 | |
| C. | 碱金属单质均为银白色,从Li到Cs,密度逐渐增大 | |
| D. | 碱金属元素形成的阳离子,从Li+到Cs+,氧化性依次增强 |
| A. | 乙醇、丙醇 | B. | 乙醇、乙二醇 | C. | 1-丙醇、2-丙醇 | D. | 乙烯、乙烷 |
| A. | 分离液态空气制氮气 | B. | 闪电时氮气转化为一氧化氮 | ||
| C. | 氨气和硫酸反应制化肥 | D. | 氨气催化氧化制硝酸 |
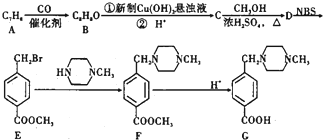

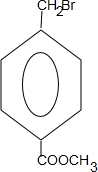 +2NaOH$→_{△}^{水}$
+2NaOH$→_{△}^{水}$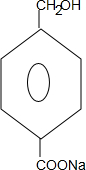 +CH3OH+NaBr
+CH3OH+NaBr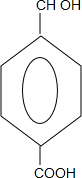 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$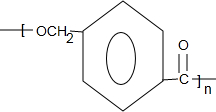 +nH2O
+nH2O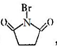 ,则关于NBS与D反应生成E的 说法错误的是 ( )
,则关于NBS与D反应生成E的 说法错误的是 ( )