题目内容
一定条件下,某反应达到平衡,其平衡常数为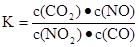 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
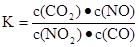 恒容时,升高温度,混合气体的颜色加深,下列说法正确的是
恒容时,升高温度,混合气体的颜色加深,下列说法正确的是| A.该反应的化学方程式为:NO2+CO===CO2+NO |
| B.该反应的焓变为负值 |
| C.升高温度,正反应速率减小 |
| D.恒温时,增大压强,颜色加深,因平衡左移 |
B
A:该反应应该是可逆反应:NO2+CO CO2+NO
CO2+NO
B:升温,混合气体的颜色加深,即NO2的浓度增大,平衡左移,故正反应为放热反应,焓变为负值,正确
C:升温,正逆反应速率均增大
D:由于两边气体系数相等,加压平衡并不能移动,体系颜色加深,是由于体积减小,NO2浓度增大的原因
 CO2+NO
CO2+NOB:升温,混合气体的颜色加深,即NO2的浓度增大,平衡左移,故正反应为放热反应,焓变为负值,正确
C:升温,正逆反应速率均增大
D:由于两边气体系数相等,加压平衡并不能移动,体系颜色加深,是由于体积减小,NO2浓度增大的原因

练习册系列答案
相关题目
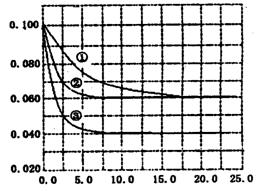
 2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
2NH3 △H<0。某实验室在三个不同条件的密闭容器中,分别加入N2和H2,浓度均为c(N2) =" 0.100mol/L," c(H2) = 0.300mol/L,进行反应时, N2的浓度随时间的变化如图①、②、③曲线所示。
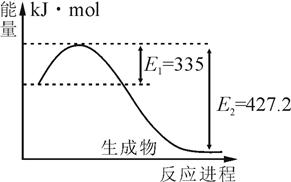
 CO(g)+H2(g);ΔH= ▲ 。(用含ΔH1、ΔH2的代数式表示)
CO(g)+H2(g);ΔH= ▲ 。(用含ΔH1、ΔH2的代数式表示)
 2NH3(g) △H<0,得到如下数据:
2NH3(g) △H<0,得到如下数据: ClF3(g);△H<0。下列叙述中正确的是
ClF3(g);△H<0。下列叙述中正确的是 CH3CH2OH(g)+3H2O(g)。
CH3CH2OH(g)+3H2O(g)。 温度(K)
温度(K) CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。
CH3OH(g)+H2O(g)。2min末该反应达到平衡,测得CH30H的浓度为0.2mol/L。下列判断不正确的是___ _。

 溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为
溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为 ,则生成沉淀所需CaCl2溶液的最小浓度为 。
,则生成沉淀所需CaCl2溶液的最小浓度为 。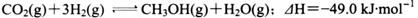
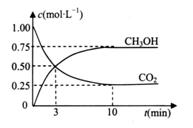
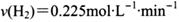
 . 若保持温度不变,
. 若保持温度不变, 向该容器中再充入1mol CO2和3molH2,平衡时
向该容器中再充入1mol CO2和3molH2,平衡时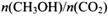 减小
减小 C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。
C分别在三种不同实验条件下进行,它们的起始状态均为c(A)=0.100 mol·L-1、c(B)=0.200mol·L-1、c(C)=0 mol·L-1. 在三种条件下,反应物A的浓度随时间的变化如右图所示。