题目内容
2.以下物质按照强电解质、弱电解质、非电解质、能导电的顺序排列的选项是( )| A. | 氯化氢 氨气 甲烷 铜 | |
| B. | H2SO4 HF 乙醇 氯化钠溶液 | |
| C. | 氢氧化钡 氢氧化钙 二氧化碳 氨水 | |
| D. | 氯化氢 食醋 葡萄糖 银 |
分析 电解质是指在水溶液里或熔化状态下能够导电的化合物,水溶液中全部电离的化合物为强电解质,水溶液中部分电离的化合物为弱电解质,非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,能导电是指存在自由移动的电子或离子的物质,据此可以分析各个选项中各种的所属类别.
解答 解:A.氯化氢是强电解质,氨气为非电解质,甲烷为非电解质,铜能导电,故A错误;
B.H2SO4 是强电解质,HF属于弱电解质,乙醇为非电解质,氯化钠溶液中有自由移动的离子,能导电,故B正确;
C.氢氧化钡是强电解质,氢氧化钙是强电解质,二氧化碳为非电解质,氨水溶液能导电,故C错误;
D.氯化氢是强电解质,食醋是弱电解质的水溶液,葡萄糖为非电解质,银为金属能导电,故D错误;
故选B.
点评 本题考查了物质分类方法和概念的分析判断,掌握物质组成和概念实质是关键,题目难度不大.

练习册系列答案
相关题目
10.原子序数依次增大的4种元素a、b、c、d,它们的原子核外L层电子数分别为5、6、8、8.c+的电子层结构与Ne的电子层结构相同,d-比c+多一个电子层.下列叙述正确的是( )
| A. | 元素的非金属性:c>b | |
| B. | a与b只能形成化合物ab和ab2 | |
| C. | c和其他3种元素均能形成离子化合物 | |
| D. | c与d形成的化合物能促进水的电离 |
17.下列化学方程式或离子方程式正确的是( )
| A. | 苯酚钠溶液中通入少量二氧化碳:C6H5O-+CO2+H2O→C6H5OH+HCO3- | |
| B. | 1一氯丙烷中加入氢氧化钠溶液并加热:CH3CH2CH2Cl+NaOH$→_{△}^{水}$CH3CH=CH2↑+NaCl+H2O | |
| C. | 甲醛溶液中加入足量新制碱性Cu(OH)2悬浊液并加热HCHO+2 Cu(OH)2+NaOH$\stackrel{△}{→}$HCOONa+Cu2O↓+3H2O | |
| D. | 向小苏打溶液中加入醋酸:CO32-+2CH3COOH═CO2↑+H2O+2CH3COO- |
7.下列有机反应属于取代反应的是( )
| A. | 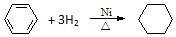 | |
| B. | CH2=CH2$\stackrel{催化剂}{→}$ 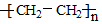 | |
| C. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O | |
| D. | C2H5OH+3O2$\stackrel{点燃}{→}$2CO2+3H2O |
11.下列实验操作、现象及由此得出的结论均正确的是( )
| 选项 | 实验操作 | 现象 | 结论 |
| A | 将铜粉加入1.0mol•L-1Fe2(SO4)3溶液中 | 铜粉溶解 | 金属铜比铁活泼 |
| B | 将pH试纸放在玻片上,用玻璃棒蘸取某新制氯水,点在pH试纸中央,与标准比色卡对照 | pH=2 | 氯气与水反应生成了强酸 |
| C | 向含有Fe2+的MgSO4溶液中,先加H2O2溶液,然后再调溶液的pH约为5 | 有红褐色沉淀生成 | Fe2+被H2O2氧化为Fe3+ |
| D | 将KI和FeCl3溶液在试管中混合后,加入汽油,振荡,静置 | 下层溶液显紫红色 | 生成的I2全部溶于汽油中 |
| A. | A | B. | B | C. | C | D. | D |
12.常温下,下列各组离子一定能大量共存的是( )
| A. | 使甲基橙试液变红的溶液中:Al3+ Cu2+NO3-SO42- | |
| B. | pH>7的溶液中:Na+Mg2+SO42-I- | |
| C. | 由水电离出的c(H+)=l.0×10-13 mol•L-1的溶液中:Na+CO32-SO32-Cl- | |
| D. | 加铝粉能产生大量H2的溶液中:Na+NH4+NO3-Cl- |
 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )