题目内容
16.下列物质在常温常压下为气体的是( )| A. | 溴乙烷 | B. | 乙烯 | C. | 乙醇 | D. | 甲苯 |
分析 卤代烃、醛、羧酸、醇类、苯的同系物都是分子晶体,熔沸点与相对分子质量成正比,含有氢键的物质熔沸点升高,常温下,苯的同系物都是液态,羧酸、醇类物质都是液态,除了甲醛为其它醛类物质呈液态,一氯甲烷为气态,其它为液态.
解答 解:A、常温常压下,除了一氯甲烷为气体,随着碳原子数的增多和卤素原子的相对分子质量的增大,熔沸点升高,故溴乙烷为液态,故A错误;
B、乙烯在常温常压下为气体,故B正确;
C、由于醇分子间存在氢键,故熔沸点比相同碳原子数的烃高,故乙醇为液态,故C错误;
D、碳原子数大于等于5的烃类均为液态,故甲苯在常温常压下为液态,故D错误.
故选B.
点评 本题以物质状态为载体考查晶体熔沸点比较,明确分子晶体熔沸点高低影响因素是解本题关键,注意化学键不影响熔沸点而影响物质稳定性,为易错点,题目难度不大.

练习册系列答案
相关题目
9.某元素原子结构示意图为 ,该原子( )
,该原子( )
 ,该原子( )
,该原子( )| A. | 核电荷数为32 | B. | 核外电子数为16 | C. | 最外层电子数为6 | D. | 核外电子层数为3 |
7.A是一种含碳、氢、氧三种元素的有机化合物.已知:A中碳的质量分数为52.16%,氢的质量分数为13.14%,那么A的实验式是( )
| A. | C2H6O | B. | CH3O | C. | C4H12O2 | D. | C5H10O4 |
4.雾霾天气肆虐给人类健康带来了严重影响.燃煤和汽车尾气是造成空气污染的原因之一.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①反应的速率时间罔像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是BC(填对应字母).
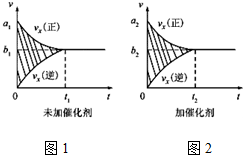
A.a1>a2,B.b1<b2 C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
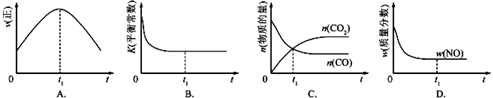
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号)
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
①该反应是吸热反应(填“吸热”或“放热”).
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).
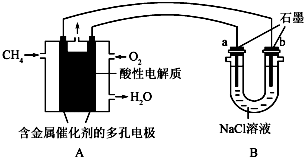
①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO$?_{加热}^{催化剂}$2CO2(g)+N2(g)△H<O
①反应的速率时间罔像如图1所示.若其他条件不变,仅在反应前加入合适的催化剂,其速率时间图象如图2所示.以下说法正确的是BC(填对应字母).

A.a1>a2,B.b1<b2 C.t1>t2
D.图2中阴影部分面积更大
E.图1中阴影部分面积更大
②若该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是BD(填代号)

(2)直接排放煤燃烧产生的烟气会引起严重的环境问题.煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染.
已知:CH4(g)+2NO2(g)?N2(g)+CO2(g)+2H2O(g)△H=-867kJ/mol
2NO2(g)?N2O4(g)△H=-56.9kJ/mol H2O(g)=H2O(l)△H=-44.0kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式:CH4(g)+N2O4(g)═N2(g)+2H2O(l)+CO2(g)△H=-898.1kJ/mol.
(3)CH4和H2O(g) 在催化剂表面发生反应CH4+H2O?CO+3H2,该反应在不同温度下的化学平衡常数如表:
| 温度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常数 | 0.45 | 1.92 | 276.5 | 1771.5 |
②T℃时,向1L密闭容器中投人l mol CH4和l mol H2O(g),平衡时c(CH4)=0.5mol/L,该温度下反应CH4+H2O?CO+3H2的平衡常数K=6.75.
(4)甲烷燃料电池可以提升能量利用率.如图是利用甲烷燃料电池电解100ml1mol/L食盐水,电解一段时间后,收集到标准状况下的氢气2.24L(设电解后溶液体积不变).

①甲烷燃料电池的负极反应式:CH4-8e-+2H2O=CO2+8H+
②电解后溶液的pH=14(忽略氯气与氢氧化钠溶液反应)
③阳极产生气体的体积在标准状况下是1.68L.
11.下表是周期表中的一部分,根据A~I在周期表中的位置,用相对应的元素符号或化学式 回答下列问题.
表中元素,原子半径最小的是H,原子半径最大的是Na化学性质最不活泼的是Ne,氧化性最强的单质是F2.
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 一 | H | |||||||
| 二 | C | N | F | Ne | ||||
| 三 | Na | Al | P | S |
8.下列说法中不正确的是( )
| A. | 电子数相同的粒子不一定属于同种元素 | |
| B. | 两个原子如果核外电子排布相同,一定属于同种元素 | |
| C. | 质子数相同,电子数也相同的两种粒子,不可能是一种分子和一种离子 | |
| D. | 所含质子数和电子数相等的粒子一定是原子 |
5.某无色溶液含有下列离子中的若干种:H+、NH4+、Fe3+、Ba2+、Al3+、CO32-、Cl-、OH-、NO3-.酸性或碱性条件下,溶液中能大量存在的离子最多有( )
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
6.CuSO4溶液中加入过量KI溶液,产生白色CuI沉淀,溶液变棕色.向反应后溶液中通入过量SO2,溶液变成无色.下列说法错误的是( )
| A. | 滴加KI溶液时,KI被氧化,CuI是还原产物 | |
| B. | 通入SO2后,溶液变无色,体现SO2的还原性 | |
| C. | 上述实验条件下,物质的氧化性:Cu2+>I2>SO2 | |
| D. | 整个过程发生了复分解反应和氧化还原反应 |