题目内容
18. 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
硫酸工业尾气中的SO2经分离后,可用于制备硫酸,同时获得电能,装置如图所示(电极均为惰性材料):M极发生的电极反应式为SO2+2H2O-2e-=SO42-+4H+.
分析 硫酸工业尾气中的SO2经分离后,可用于制备硫酸,是二氧化硫失电子得到硫酸根的氧化反应过程,在原电池负极发生氧化反应,据此回答.
解答 解;硫酸工业尾气中的SO2经分离后,可用于制备硫酸,是二氧化硫失电子得到硫酸根的氧化反应过程,该反应过程是原电池负极发生的反应,所以M是负极,该电极上SO2被氧化生成SO42-,负极电极反应式为SO2+2H2O-2e-=SO42-+4H+,故答案为:SO2+2H2O-2e-=SO42-+4H+.
点评 本题考查学生原电池的工作原理以及电极反应式的书写知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.就有关物质的分离回答下面的问题,有一瓶A和B的混合液,已知它们的性质如表.
据此分析,将A和B相互分离的常用方法是蒸馏.
| 物质 | 熔点/°C | 沸点/°C | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水 |
| B | 17.9 | 290 | 1.26 |
6.下列混合物可用溶解、过滤、蒸发的操作达到分离目的是( )
| A. | 面粉和食盐的混合物 | B. | 石灰石与泥沙的混合物 | ||
| C. | 碘与酒精的混合物 | D. | 泥沙与氯化钠的混合物 |
13.用下列装置进行相应实验,装置正确且能达到实验目的是( )
| A. |  用图所示装置验证NaHCO3的不稳定性 用图所示装置验证NaHCO3的不稳定性 | |
| B. | 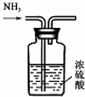 用图所示装置干燥氨气 用图所示装置干燥氨气 | |
| C. | 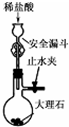 用图所示装置制取少量CO2气体 用图所示装置制取少量CO2气体 | |
| D. |  用图所示装置分馏石油 用图所示装置分馏石油 |
3.下列有关物质分类或归类正确的是( )
①液氨、液氯、干冰、碘化银均为化合物
②铝热剂、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、冰醋酸、生石灰均为电解质
④Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物.
①液氨、液氯、干冰、碘化银均为化合物
②铝热剂、盐酸、水玻璃、氨水均为混合物
③明矾、小苏打、冰醋酸、生石灰均为电解质
④Na2O2、MgCl2、NaOH、NH4Cl均为含共价键的离子化合物.
| A. | ①和② | B. | ②和③ | C. | ③和④ | D. | ①和④ |
7.甲同学将Na2O2分别与H2O和浓盐酸反应,有如下现象:
请完成下列问题:
实验I中:
(1)该反应是放热反应(填“放热”或“吸热”).
(2)反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)证明无色无味气体是氧气的方法是将带火星的木条放在试管口,复燃则证明是氧气.
实验Ⅱ中:
(4)根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O.
(5)若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验Ⅰ相同的气体,原因是黄绿色溶液中存在H2O2,加入FeCl3使H2O2分解速率加快,立即产生氧气.
| 实验序号 | 使用药品 | 现象 |
| Ⅰ | Na2O2、H2O | ①试管壁发热 ②有无色无味气体产生 |
| Ⅱ | Na2O2、浓盐酸 | ①试管壁发热 ②有刺激性气味的气体产生 ③反应后所得溶液呈浅黄绿色 |
实验I中:
(1)该反应是放热反应(填“放热”或“吸热”).
(2)反应的化学方程式是2Na2O2+2H2O=4NaOH+O2↑.
(3)证明无色无味气体是氧气的方法是将带火星的木条放在试管口,复燃则证明是氧气.
实验Ⅱ中:
(4)根据现象②、③,推测生成的气体中可能含有Cl2,产生Cl2的化学方程式是Na2O2+4HCl(浓)=2NaCl+Cl2↑+2H2O.
(5)若往“浅黄绿色溶液”中加入FeCl3溶液,立即产生与实验Ⅰ相同的气体,原因是黄绿色溶液中存在H2O2,加入FeCl3使H2O2分解速率加快,立即产生氧气.
8.下列有关胶体的叙述正确的是( )
| A. | 直径介于1--10nm之间的粒子称为胶体 | |
| B. | 利用丁达尔效应可以区别溶液与胶体 | |
| C. | 氢氧化铁胶体是纯净物 | |
| D. | 可以通过过滤的方法分离胶体和溶液 |