题目内容
16.用广谱高效的二氧化氯(ClO2)替代液氯进行消毒,可避免产生对人体健康有害的有机氯代物.(1)二氧化氯(ClO2)是目前国际上公认的第四代高效、无毒的广谱消毒剂,它可由KClO3在H2SO4存在下与Na2SO3反应制得.请写出反应的离子方程式:2ClO3-+SO32-+2H++SO42-═2ClO2↑+2SO42-+H2O.
(2)漂白剂亚氯酸钠(NaClO2)在常温黑暗处可保存一年,亚氯酸不稳定可分解,反应的离子方程式为:HClO2→ClO2↑+H++Cl-+H2O(未配平).当1molHClO2发生分解反应时,转移的电子个数是0.8NA.
(3)有效氯含量是含氯消毒剂的一个重要指标,有效氯含量的定义为:从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比,常用百分数表示.则ClO2的有效氯含量是263%.
分析 (1)KClO3在H2SO4存在下与Na2SO3发生氧化还原反应,反应生成二氧化氯,硫酸钠和水,结合原子守恒和电荷守恒配平书写离子方程式;
(2)根据化合价变化来配平书写离子方程式,依据方程式中定量关系计算转移的电子数;
(3)由Cl2 +2HI=I2+2HCl、2ClO2+10HI=2HCl+5I2+4H2O,结合从HI中氧化出相同量的I2所需Cl2的质量与指定含氯消毒剂的质量之比计算.
解答 解:(1)由信息可知,KClO3在H2SO4存在下与Na2SO3发生氧化还原反应,反应生成二氧化氯,硫酸钠和水,发生反应的化学方程式为:2NaClO3+Na2SO3+H2SO4═2ClO2↑+2Na2SO4+H2O,离子方程式为:2ClO3-+SO32-+2H++SO42-═2ClO2↑+2SO42-+H2O,
故答案为:2ClO3-+SO32-+2H++SO42-═2ClO2↑+2SO42-+H2O;
(2)由HClO2→ClO2↑+H++Cl-+H2O可知,反应物中Cl元素的化合价既升高又降低,配平得到离子方程式为:5HClO2=4ClO2↑+H++Cl-+2H2O,反应中每5molHClO2分解电子转移总物质的量为4mol,当有1molHClO2分解时,转移的电子数为$\frac{4}{5}$×NAmol-1=0.8NA,
故答案为:0.8NA;
(3)由Cl2 +2HI=I2+2HCl、2ClO2+10HI=2HCl+5I2+4H2O可知,均生成5molI2时需要氯气、二氧化氯的物质的量比为5:2,所以ClO2的有效氯含量为$\frac{5×71}{2×67.5}$×100%=263%,
故答案为:263%.
点评 本题考查氧化还原反应的计算,把握习题中的信息及发生的氧化还原反应为解答的关键,侧重学生分析能力及计算能力的考查,题目难度中等.

| A. | m=4,n=2 | B. | m=4,n=5 | C. | m=3,n=3 | D. | m=5,n=3 |
| A. | 1L 0.1mol•L-1 的KCl溶液 | B. | 0.1L 0.2mol•L-1的盐酸溶液 | ||
| C. | 0.1L 0.1 mol•L-1的MgCl2溶液 | D. | 0.1L 0.1mol•L-1的AlCl3溶液 |
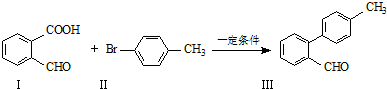
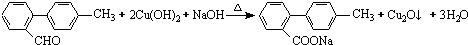 .
.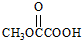 与
与  也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为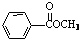 .
.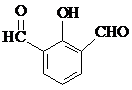 、
、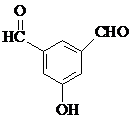 、
、 (要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)
(要求:①能与FeCl3溶液发生显色反应;②苯环上一氯取代产物有2种)