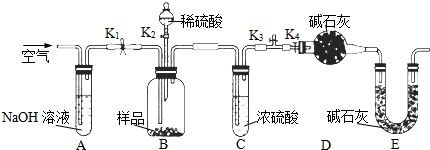
题目内容
写出下列各实验操作时所需方法或实验仪器的名称:
方法(1)泥沙与水 ,(2)从溴水中提取溴 ,(3)水与乙醇 ,
仪器(4)配制480mL 1mol?L-1的NaOH溶液 ,(5)分离汽油与水 .
方法(1)泥沙与水
仪器(4)配制480mL 1mol?L-1的NaOH溶液
考点:物质的分离、提纯的基本方法选择与应用,物质的分离、提纯和除杂
专题:化学实验基本操作
分析:(1)泥沙不溶于水;
(2)溴不易溶于水,易溶于有机溶剂;
(3)水与乙醇混溶,但沸点不同;
(4)配制溶液需要容量瓶;
(5)汽油与水分层.
(2)溴不易溶于水,易溶于有机溶剂;
(3)水与乙醇混溶,但沸点不同;
(4)配制溶液需要容量瓶;
(5)汽油与水分层.
解答:
解:(1)泥沙不溶于水,则选择过滤法分离,故答案为:过滤;
(2)溴不易溶于水,易溶于有机溶剂,则选择萃取、分液、蒸馏法得到溴,故答案为:萃取、分液、蒸馏;
(3)水与乙醇混溶,但沸点不同,则选择加CaO后蒸馏分离,故答案为:蒸馏;
(4)配制480mL 1mol?L-1的NaOH溶液,需要500mL容量瓶、烧杯、玻璃棒、胶头滴管及托盘天平等,
故答案为:500mL容量瓶、烧杯、玻璃棒、胶头滴管及托盘天平;
(5)汽油与水分层,选择分液法,需要分液漏斗、烧杯、铁架台等,故答案为:分液漏斗、烧杯、铁架台.
(2)溴不易溶于水,易溶于有机溶剂,则选择萃取、分液、蒸馏法得到溴,故答案为:萃取、分液、蒸馏;
(3)水与乙醇混溶,但沸点不同,则选择加CaO后蒸馏分离,故答案为:蒸馏;
(4)配制480mL 1mol?L-1的NaOH溶液,需要500mL容量瓶、烧杯、玻璃棒、胶头滴管及托盘天平等,
故答案为:500mL容量瓶、烧杯、玻璃棒、胶头滴管及托盘天平;
(5)汽油与水分层,选择分液法,需要分液漏斗、烧杯、铁架台等,故答案为:分液漏斗、烧杯、铁架台.
点评:本题考查混合物分离提纯等,为高频考点,把握物质的性质及分离方法、分离原理等为解答的关键,侧重性质及应用、实验能力的考查,题目难度不大.

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案
相关题目
下列说法不正确的是( )
| A、手机上用的锂离子电池属于二次电池 |
| B、锌锰干电池中,锌电极是负极 |
| C、二次电池的化学反应是可逆反应 |
| D、氢氧燃料电池的产物为水,属于环境友好电池 |
化学科学对提高人类生活质量和促进社会发展具有重要作用,下列说法中正确的是( )
| A、煤经过气化和液化两个物理变化,可变为清洁能源 |
| B、自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 |
| C、汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一 |
| D、用聚氯乙烯代替聚乙烯作食品包装袋.有利于节约使用成本 |