题目内容
2.植物及其废弃物可以制取乙醇燃料,下列关于乙醇燃料的说法错误的是( )| A. | 它与甲醚(CH3-O-CH3)互为同分异构体 | |
| B. | 乙醇易燃烧,污染小 | |
| C. | 乙醇只能在实验室内作燃料 | |
| D. | 粮食作物是制乙醇的重要原料 |
分析 乙醇与二甲醚分子式相同,结构不同,互为同分异构体,乙醇易燃烧,为良好的清洁能源,燃烧生成二氧化碳和水,以此解答该题.
解答 解:A.乙醇与甲醚(CH3-O-CH3)分子式相同,结构不同,互为同分异构体,故A正确;
B.乙醇易燃烧,为良好的清洁能源,燃烧生成二氧化碳和水,故B正确;
C.乙醇可用于乙醇汽油等,故C错误;
D.淡粉、纤维素可水解生成葡萄糖,进一步氧化生成乙醇,故D正确.
故选C.
点评 本题考查乙醇的性质与应用,为高频考点,侧重于化学与生活、生产的考查,有利于培养学生的良好的科学素养,提高学习的积极性,难度不大.

练习册系列答案
相关题目
12. 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
(1)测定蓝矾属于晶体的物理方法是X-射线衍射.其中SO42-中S原子的轨道杂化形式是sp3;H2O的空间构型是V形.
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是CuSO4(化学式);A溶于水配成溶液,加入氨水,观察到的现象是首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中的含铜元素的离子是[Cu(NH3)4]2+(化学式),该离子含有的化学键类型有配位键、极性键.
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是1s22s22p63s22p63d10;
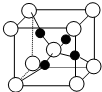
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是2.
③已知该晶体的密度为dg•cm-3,则晶胞参数是$\root{3}{\frac{288}{{N}_{A}d}}$×1010pm.
 硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:
硫酸铜晶体,俗称蓝矾、胆矾,具有催吐,祛腐,解毒.取5.0g胆矾样品逐渐升高温度使其分解,分解过程的热重如表.回答下列问题:| 温度范围/℃ | 固体质量/g |
| 258~680 | 3.20 |
| 680~1000 | 1.60 |
| 1000以上 | 1.44 |
(2)将硫酸铜晶体加热到258~680℃生成的物质A,A是CuSO4(化学式);A溶于水配成溶液,加入氨水,观察到的现象是首先形成蓝色沉淀,继续加入氨水,沉淀溶解,得到深蓝色溶液;最终得到溶液中的含铜元素的离子是[Cu(NH3)4]2+(化学式),该离子含有的化学键类型有配位键、极性键.
(3)将硫酸铜晶体加热到1000℃以上生成的物质C,在C中的铜的离子的基态电子排布式是1s22s22p63s22p63d10;
(4)如图是硫酸铜晶体分解得到一定温度的产物的晶胞(白球和黑球代表不同的原子).
①该温度是1000℃以上.
②铜原子的配位数是2.
③已知该晶体的密度为dg•cm-3,则晶胞参数是$\root{3}{\frac{288}{{N}_{A}d}}$×1010pm.
17.设NA表示阿佛加德罗常数的值,下列说法不正确的是( )
| A. | 1mol醋酸的质量与NA个醋酸分子的质量相等 | |
| B. | NA个氧分子和NA个氢分子的质量比为16:1 | |
| C. | 28g氮气所含原子数目为NA | |
| D. | 在标准状况下,0.5NA个氯气分子所占的体积约是11.2L |
7.下列溶液中,呈酸性的是( )
| A. | Na2CO3 | B. | Na2SO4 | C. | NH4Cl | D. | BaCl2 |
14.实验室配制氯化铁溶液时,把氯化铁溶解在稀盐酸中.这样操作的目的是( )
| A. | 加快氯化铁的溶解 | B. | 提高溶液的pH | ||
| C. | 抑制氯化铁的水解 | D. | 增大氯化铁的溶解度 |
11.为了除去括号内的杂质,其试剂选择和分离方法都正确的是( )
| 序号 | 物质(杂质) | 所用试剂 | 分离方法 |
| A | 溴苯(Br2) | 苯 | 萃取、分液 |
| B | CO2(HCl) | 饱和NaHCO3溶液 | 洗气 |
| C | C2H4(SO2) | 酸性高锰酸钾 | 洗气 |
| D | CH3CH2OH(H2O) | 生石灰 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
12.关于下列装置说法正确的是( )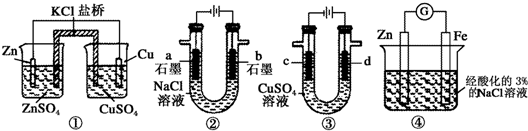

| A. | 装置①中,一段时间后左侧SO42-浓度增大 | |
| B. | 装置②中滴入酚酞,b极附近先变红 | |
| C. | 用装置③精炼铜时,c极为粗铜 | |
| D. | 装置④中在Fe电极附近滴入K3[Fe(CN)6]溶液,可验证Fe电极被保护 |
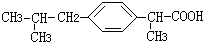
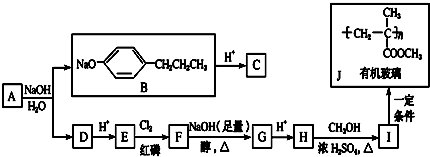
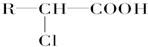 +HCl
+HCl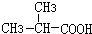 、G
、G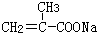 .
.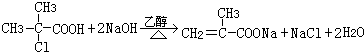 ;H→I
;H→I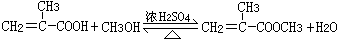 .
.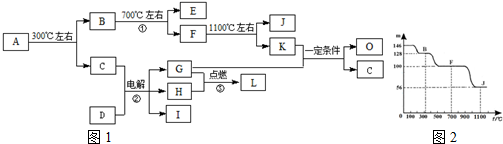
 ;
;