题目内容
13.阿托酸甲酯(Y)能用于治疗肠道疾病,它可由阿托酸(X)经过下列反应合成:
下列说法正确的是( )
| A. | X可用于合成高分子化合物,Y不能合成高分子化合物 | |
| B. | X在烧碱溶液中变质,而Y在烧碱溶液中不变质 | |
| C. | X分子中所有原子均可能共平面 | |
| D. | X和Y分别与浓硝酸反应都能生成5种二硝基取代物 |
分析 A.X、Y中均含碳碳双键;
B.X中含-COOH,Y中含-COOC-,均与NaOH反应;
C.苯环、碳碳双键、羰基均为平面结构,且直接相连;
D.苯环上二取代有邻、间、对三种.
解答 解:A.X、Y中均含碳碳双键,则均可发生加聚反应生成高分子,故A错误;
B.X中含-COOH,Y中含-COOC-,均与NaOH反应,则均变质,故B错误;
C.苯环、碳碳双键、羰基均为平面结构,且直接相连,则X分子中所有原子均可能共平面,故C正确;
D.苯环上二取代有邻、间、对三种,则X和Y分别与浓硝酸反应都能生成3种二硝基取代物,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质、有机反应为解答的关键,侧重分析与应用能力的考查,注意烯烃性质的应用,题目难度不大.

练习册系列答案
相关题目
4.化学与生产、生活息息相关,下列有关说法正确的是( )
| A. | 树林晨曦中见到的缕缕阳光,是丁达尔效应效应造成的 | |
| B. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| C. | 神舟11号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是二氧化硅 | |
| D. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 |
1.下列有关化学用语表示正确的是( )
| A. | 次氯酸的结构式:H-Cl-O | B. | 1H、2H、3H是同一种核素 | ||
| C. | S2-的结构示意图: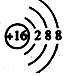 | D. | 四氯化碳的电子式: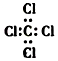 |
8.氯化亚铁具有独有的脱色能力,适用于染料、染料中间体、印染、造纸行业的污水处理.某课题小组设计如下方案制备氯化亚铁并探究氯化亚铁(Fe2+)的还原性.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置D中发生的化学方程式是:2FeCl3+H2$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+2FeCl2
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
①写出滴定过程中所发生的2个离子方程式MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O,2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O
②样品中氯化亚铁的质量分数为70.1%.
某同学选择下列装置用氯化铁制备少量氯化亚铁(装置不可以重复使用).查阅资料知,氯化铁遇水剧烈水解,在加热条件下氢气还原氯化铁生成FeCl2.

(1)实验开始前应先检查装置的气密性,请叙述装置A气密性检验的方法:关闭活塞,向长颈漏斗内注水至形成一段水柱且液面高度不变,说明装置气密性良好
(2)气流从左至右,装置接口连接顺序是ab c e f d
(3)装置C中干燥管中所盛试剂的名称是:碱石灰或生石灰,作用是:除去HCl、并防止空气中水的进入
(4)装置D中发生的化学方程式是:2FeCl3+H2$\frac{\underline{\;\;△\;\;}}{\;}$2HCl+2FeCl2
(5)为了测定氯化亚铁的质量分数,某同学进行了如下实验:
称取实验制备的氯化亚铁样品5.435g,配成溶液,用1.00mol•L-1酸性KMnO4标准溶液滴定至终点.(已知还原性Fe2+>Cl-)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | |
| 1 | 1.04 | 25.03 |
| 2 | 1.98 | 25.99 |
| 3 | 3.20 | 25.24 |
②样品中氯化亚铁的质量分数为70.1%.
5.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等 | |
| B. | 10g浓度为46%的乙醇水溶液中含有的氢原子总数为1.2NA | |
| C. | 2 g H2分别与足量的C12和N2充分反应后转移的电子数均为2NA | |
| D. | 1molFe(OH)3与含3molHI的溶液完全反应后,溶液中所含I-的数目为3NA |
2.某化学小组同学用下列装置和试剂进行实验,探究O2与KI溶液发生反应的条件.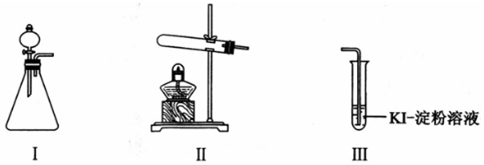
供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如表:
(2)丙实验中O2与KI溶液反应的离子方程式是O2+4I-+4H+=2I2+2H2O.
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是酸性环境.为进一步探究该条件对反应速率的影响,可采取的实验措施是使用不同浓度的稀硫酸作对比实验.
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝.学生将I中产生的气体直接通入下列AD溶液(填序号),证明了白雾中含有H2O2.
A.酸性 KMnO4 B.FeCl2 C.Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)3I2+6OH-=5I-+IO3-+3H2O造成的,请设计实验证明他们的猜想是否正确在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误.

供选试剂:30% H2O2溶液、0.1mol/L H2SO4溶液、MnO2固体、KMnO4固体
(1)小组同学设计甲、乙、丙三组实验,记录如表:
| 操作 | 现象 | |
| 甲 | 向I的锥形瓶中加入MnO2固体,.向I的分液漏斗中加入30% H2O2溶液,连接I、Ⅲ,打开活塞 | I中产生无色气体并伴随大量白雾;Ⅲ中有气泡冒出,溶液迅速变蓝 |
| 乙 | 向Ⅱ中加入KMnO4固体,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液不变蓝 |
| 丙 | 向Ⅱ中加入KMnO4固体,Ⅲ中加入适量0.1mol/L H2SO4溶液,连接Ⅱ、Ⅲ,点燃酒精灯 | Ⅲ中有气泡冒出,溶液变蓝 |
(3)对比乙、丙实验可知,O2与KI溶液发生反应的适宜条件是酸性环境.为进一步探究该条件对反应速率的影响,可采取的实验措施是使用不同浓度的稀硫酸作对比实验.
(4)由甲、乙、丙三实验推测,甲实验可能是I中的白雾使溶液变蓝.学生将I中产生的气体直接通入下列AD溶液(填序号),证明了白雾中含有H2O2.
A.酸性 KMnO4 B.FeCl2 C.Na2S D.品红
(5)资料显示:KI溶液在空气中久置过程中会被缓慢氧化:4KI+O2+2H2O=2I2+4KOH.该小组同学取20mL久置的KI溶液,向其中加入几滴淀粉溶液,结果没有观察到溶液颜色变蓝,他们猜想可能是发生了反应(写离子方程式)3I2+6OH-=5I-+IO3-+3H2O造成的,请设计实验证明他们的猜想是否正确在上述未变蓝的溶液中滴入0.1mol/LH2SO4溶液观察现象,若溶液变蓝则猜想正确,否则错误.
13.用下列实验装置完成对应的实验(部分仪器已省略),能达到实验目的是( )
| A. | 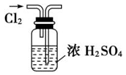 干燥Cl2 干燥Cl2 | B. |  吸收HCl | C. | 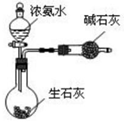 制备干燥的氨气 | D. | 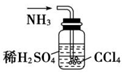 吸收NH3 |
 钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示:
钠硫电池是一种新型可充电电池,它以熔融的金属钠作为电极的反应物,以熔融的硫和多疏化钠(Na2Sx,熔融状态下可电离出Na,和S42-的混合物作一个电极的反应物,以固体Al2O3陶瓷(可传导Na,但不能传导阴离子)为电解质,电池总反应为2Na+xS═Na2Sx.工作原理如图所示: