题目内容
12.篮烷的结构如图所示,下列说法正确的是( )
| A. | 篮烷的分子式为C12H20 | |
| B. | 篮烷分子中存在2个六元环 | |
| C. | 篮烷分子中存在3个五元环 | |
| D. | 篮烷的一氯代物共有4种同分异构体 |
分析 A、交点为C原子,交点之间的短线是化学键,利用H原子饱和碳的四价结构,据此书写分子式;
B、交点为C原子,根据分子结构中环中含有的碳原子数目,进行判断;
C、交点为C原子,根据分子结构中环中含有的碳原子数目,进行判断;
D、该分子属于高度对称结构,根据对称性判断分子中等效H原子数目,有几种H原子,其一氯代物就有几种异构体.
解答 解:A、由蓝烷的结构可知,分子中含有12个C原子、14个H原子,分子式为C12H14,故A错误;
B、由蓝烷的结构可知,有如图 所示的ABCDEF、ABCHGF、CDEFGH 3个六元环,故B错误;
所示的ABCDEF、ABCHGF、CDEFGH 3个六元环,故B错误;
C、由蓝烷的结构可知,有如图 所示的ABCDE、与A′B′C′D′E′2个五元环,故C错误;
所示的ABCDE、与A′B′C′D′E′2个五元环,故C错误;
D、该分子属于高度对称结构,有如图 所示的4种H原子,故其一氯代物就有4种同分异构体,故D正确;
所示的4种H原子,故其一氯代物就有4种同分异构体,故D正确;
故选D.
点评 本题考查有机物的结构、同分异构体等,题目难度中等,实际是键线式结构,注意对结构的仔细观察,侧重于考查学士的分析能力.

练习册系列答案
相关题目
17.将装有25mLNO、NO2混合气体的量筒倒立于水槽中,充分反应后容器内气体体积缩小为15mL,则原混合气体中NO、NO2的体积比是( )
| A. | 3:2 | B. | 2:3 | C. | 4:1 | D. | 1:4 |
1. 可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
 可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )
可逆反应2A+B?2C(g)(正反应放热),随温度变化气体平均摩尔质量如图所示,则下列叙述正确的是( )| A. | A和B可能都是固体 | B. | A和B一定都是气体 | ||
| C. | 若B为固体,则A一定是气体 | D. | A和B不可能都是气体 |
19. 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
( )
 科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是
科学家用氮化镓材料与铜组装如图所示人工光合系统,利用该装置成功地实现了以CO2和H20合成CH4.下列有关说法正确的是( )
| A. | 该装置中存在两种能量的转换形式 | |
| B. | 电池工作时,H+向负极移动 | |
| C. | 为提高该人工光合系统的工作效率,最好向装置中加入少量盐酸 | |
| D. | 铜电极表面的电极反应式为:C02+8e-+8H+═CH4+2H20 |
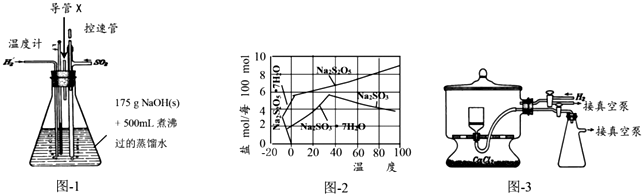
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.