题目内容
【题目】下列有关说法正确的是
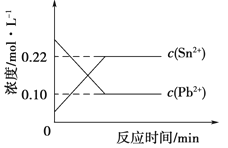
A.图所示装置可构成铜-锌原电池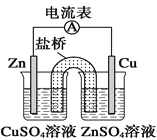
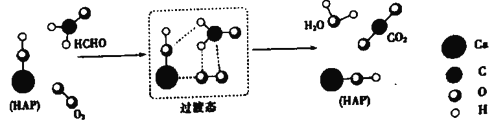
B.图是HI(g)分解能量与反应进程关系曲线,a、b中I2依次为固态、气态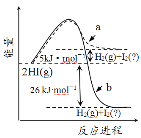
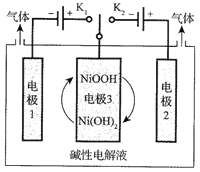
C.图所示装置可以实现电解精炼铝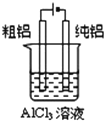
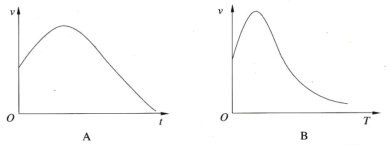
D.图实验设计可用于探究催化剂Fe3+、Cu2+对过氧化氢分解速率的影响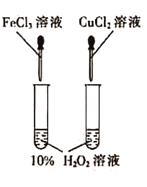
【答案】D
【解析】
A.铜-锌、硫酸铜构成原电池,锌作负极,锌电极插入硫酸锌溶液中,铜作正极,铜电极插入硫酸铜溶液中,才能构成原电池,故A错误;
B.同种物质在固态时的能量低于气态时的能量,因此HI(g) 分解生成氢气和固态碘,放出的热量多,因此a、b中I2依次为气态、固态,故B错误;
C.氧化性:Al3+<H+,因此在阴极得电子的是氢离子,不能得到金属铝,故C错误;
D.过氧化氢的浓度相同,氯化铁、氯化铜溶液中阴离子种类相同,阳离子种类不同,此实验设计可用于探究催化剂Fe3+、Cu2+对过氧化氢分解速率的影响,故D正确;
答案选D。

练习册系列答案
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案
相关题目
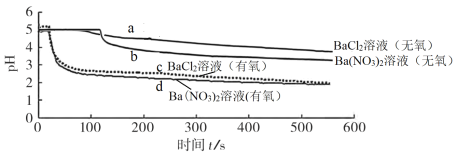
【题目】将SO2分别通入无氧、有氧的浓度均为0.1 mol·L-1的 BaCl2溶液和Ba(NO3)2溶液中,探究体系中微粒间的相互作用,实验记录如下:
实验记录 | |
pH变化 |
|
溶液中是否产生沉淀 | BaCl2溶液(无氧)中无白色沉淀、BaCl2溶液(有氧)中有白色沉淀 Ba(NO3)2溶液(无氧)中有白色沉淀、Ba(NO3)2溶液(有氧)中有白色沉淀 |
下列说法不正确的是
A.曲线a 所示溶液pH降低的原因:SO2 + H2O![]() H2SO3
H2SO3![]() H+ + HSO3-
H+ + HSO3-
B.曲线c 所示溶液中发生反应:2Ba2+ + O2 + 2SO2 + 2H2O =2BaSO4↓+ 4H+
C.与曲线a、b、c对比,可知曲线d所表示的过程中NO3-是氧化SO2的主要微粒
D.依据该实验预测0.2 mol·L-1的KNO3溶液(无氧)也可以氧化SO2