题目内容
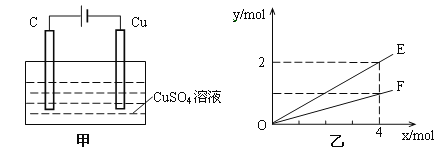
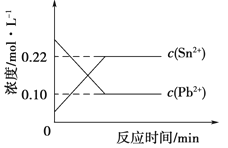
【题目】25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(Sn,发生反应:Sn(s)+Pb2+(aq)![]() Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
Sn2+(aq)+Pb(s),体系中c(Pb2+)、c(Sn2+)变化关系如图所示。下列判断正确的是( )
A.往平衡体系中加入金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量Sn(NO3)2固体后,c(Pb2+)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应正反应是吸热反应
D.25℃时,该反应的平衡常数K=2.2
【答案】D
【解析】
A. 金属铅是固体,增大铅的用量,化学平衡不移动,c(Pb2+)不变,A错误;
B. 加入少量Sn(NO3)2固体,溶液中Sn2+浓度增大,平衡向逆反应移动,c(Pb2+)增大,B错误;
C. 升高温度,平衡体系中c(Pb2+)增大,说明升高温度化学平衡向逆反应移动,逆反应为吸热反应,故该反应的正反应为放热反应,C错误;
D. 由图可知,平衡时c(Pb2+)=0.1 mol/L,c(Sn2+)=0.22 mol/L,故该温度下反应的平衡常数K= =2.2,D正确;
=2.2,D正确;
故合理选项是D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目