题目内容
 (1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式
(1)如图是1molNO2和1molCO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式(2)己知下列热化学方程式:
C(s)+O2=CO2△H=-393.5kJ.mol-1
2H2(g)+O2=2H2O(g)△H=-483.6kJ.mol-1
CO(g)+
| 1 |
| 2 |
由此可知反应:C(s)+H2O(g)=CO(g)+H2(g)的焓变为
(3)在一固定体积的密闭容器中,进行如下化学反应:
N2(g)+3H2(g)?2NH3(g)△H<0,其化学平衡常数K与t的关系如下表:
| t/K | 298 | 398 | 498 | … |
| K/(mol.L-1)-2 | 4.1X106 | K1 | K2 | … |
①试比较K1、K2的大小,K1
②下列各项能作为判断该反应达到化学平衡状态的依据的是
A.容器内N2、H2、NH3的浓度之比为1:3:2
B.2v(正)(N2)=v(逆)(H2) C.容器内压强保持不变
D.混合气体的密度保持不变 E.混合气体的平均相对分子质量不再改变
F.混合气体中各成分的浓度不再改变.
考点:热化学方程式,反应热和焓变,化学平衡状态的判断
专题:基本概念与基本理论
分析:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,根据热化学方程式书写原则进行书写;
(2)依据热化学方程式和盖斯定律计算所需热化学方程式;
(3)①依据反应是放热反应,升温平衡逆向进行,平衡常数减小分析;
②根据平衡状态的判断依据判断,正逆反应速率相同,各组分含量保持不变.
(2)依据热化学方程式和盖斯定律计算所需热化学方程式;
(3)①依据反应是放热反应,升温平衡逆向进行,平衡常数减小分析;
②根据平衡状态的判断依据判断,正逆反应速率相同,各组分含量保持不变.
解答:
解:(1)由图可知,1mol NO2和1mol CO反应生成CO2和NO放出热量234kJ,反应热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1,
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;
(2)①C(s)+O2=CO2△H=-393.5kJ.mol-1
②2H2(g)+O2=2H2O(g)△H=-483.6kJ.mol-1
③CO(g)+
O2=CO2(g)△H=-283.0kJ.mol-1
依据盖斯定律计算①-②×
-③得到:C(s)+H2O(g)=CO(g)+H2(g)△H=+131.3KJ/mol;
故答案为:+131.3KJ/mol;
(3)①N2(g)+3H2(g)?2NH3(g)△H<0,反应是放热反应,升高温度,平衡逆向进行,平衡常数减小,K1>K2;
故答案为:>;
②N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,
A、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故A错误;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3v(正)(N2)=v(逆)(H2)证明反应达到平衡状态,故B错误.
C、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误;
E、反应前后气体质量不变,气体物质的量减小,混合气体的平均相对分子质量不再改变说明反应达到平衡状态,故E正确;
F、混合气体中各成分的浓度不再改变,是破坏标志,能说明反应达到平衡状态,故F正确;
故选:CEF.
故答案为:NO2(g)+CO(g)=NO(g)+CO2(g)△H=-234 kJ?mol-1;
(2)①C(s)+O2=CO2△H=-393.5kJ.mol-1
②2H2(g)+O2=2H2O(g)△H=-483.6kJ.mol-1
③CO(g)+
| 1 |
| 2 |
依据盖斯定律计算①-②×
| 1 |
| 2 |
故答案为:+131.3KJ/mol;
(3)①N2(g)+3H2(g)?2NH3(g)△H<0,反应是放热反应,升高温度,平衡逆向进行,平衡常数减小,K1>K2;
故答案为:>;
②N2(g)+3H2(g)?2NH3(g)△H<0,反应是气体体积减小的放热反应,
A、容器内各物质的浓度之比等于计量数之比,不能证明正逆反应速率相等,故A错误;
B、不同物质的正逆反应速率之比等于其计量数之比是平衡状态,3v(正)(N2)=v(逆)(H2)证明反应达到平衡状态,故B错误.
C、容器内压强不变,气体的物质的量不变,该反应达平衡状态,故C正确;
D、如果是在密闭容器中反应,质量不变,体积不变,密度始终不变,故D错误;
E、反应前后气体质量不变,气体物质的量减小,混合气体的平均相对分子质量不再改变说明反应达到平衡状态,故E正确;
F、混合气体中各成分的浓度不再改变,是破坏标志,能说明反应达到平衡状态,故F正确;
故选:CEF.
点评:本题考查了热化学方程式和盖斯定律计算应用,化学平衡影响因素、平衡标志分析判断,平衡常数随温度的变化分析,掌握基础是关键,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列关于有机物的叙述正确的是( )
| A、乙醇可以被氧化为乙酸,二者均能发生酯化反应 |
| B、人体内的蛋白质不断分解,最终生成水和二氧化碳排出体外 |
| C、我国居民传统膳食以糖类为主,淀粉、脂肪都是糖类物质 |
D、由CH2═CH-COOCH3合成的聚合物为 |
用下列实验装置进行相应实验,能达到实验目的是( )
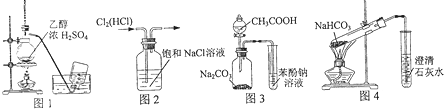

| A、利用图1装置制备乙烯 |
| B、利用图2装置除去Cl2中的HCl |
| C、利用图3装置证明酸性:CH3COOH>H2CO3>苯酚 |
| D、利用图4装置探究NaHCO3的热稳定性 |