题目内容
1.以下物质间的每步转化通过一步反应能实现的是( )| A. | Al--Al2O3--Al(OH)3--NaAlO2 | B. | Fe--FeO--Fe(OH)2--Fe(OH)3 | ||
| C. | S--SO3--H2SO4--MgSO4 | D. | Na--Na2O2--Na2CO3--NaOH |
分析 A.Al2O3不能直接通过一步反应生成Al(OH)3;
B.FeO不能一步转化为Fe(OH)2;
C.S一步不能转化为SO3;
D.钠燃烧生成过氧化钠,再与二氧化碳反应生成碳酸钠,碳酸钠和氢氧化钙反应生成NaOH.
解答 解:A.Al$\stackrel{O_{2}}{→}$Al2O3,氧化铝不能一步转化为氢氧化铝,Al(OH)3$\stackrel{NaOH}{→}$NaAlO2,故A不选;
B.Fe$→_{高温}^{O_{2}}$FeO,FeO不能一步转化为Fe(OH)2,Fe(OH)2$\stackrel{O_{2}、H_{2}O}{→}$Fe(OH)3,故B不选;
C.S一步不能转化为SO3,SO3$\stackrel{H_{2}O}{→}$H2SO4$\stackrel{Mg}{→}$MgSO4,故C不选;
D.Na$\stackrel{O_{2}}{→}$Na2O2$\stackrel{CO_{2}}{→}$Na2CO3$\stackrel{Ca(OH)_{2}}{→}$NaOH,故D选;
故选D.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握物质的性质及发生的反应为解答的关键,题目难度不大,注意常见无机物的性质,注重基础知识的积累.

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目
12.高温条件下,某钾盐发生如下反应:4K2Cr2O7═4K2CrO4+2X+3O2↑,则生成物X的是( )
| A. | CrO2 | B. | CrO3 | C. | Cr2O3 | D. | Cr2O5 |
9.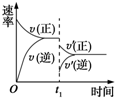 在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
 在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )
在密闭容器中进行反应:2SO2(g)+O2(g)?2SO3(g)(正反应放热),如图是某次实验的化学反应速率随时间变化的图象,推断在t1时刻突然变化的条件可能是( )| A. | 催化剂失效 | B. | 减小生成物的浓度 | ||
| C. | 降低体系温度 | D. | 增大容器的体积 |
16.在无色透明强酸性溶液中,能大量共存的离子组是( )
| A. | K+、Ca2+、HCO3-、SO42- | B. | Cl-、NO3-、Fe2+、K+ | ||
| C. | Na+、OH-、MnO4-、Ba2+ | D. | K+、Mg2+、NO3-、SO42- |
6.下列反应的离子方程式正确的是( )
| A. | .碳酸氢钙溶液中加入氢氧化钠溶液:HCO3-+OH-═CO32-+H2O | |
| B. | 用胃舒平治疗胃酸过多:Al(OH)3+3H+═Al3++3H2O | |
| C. | Na与H2O反应:Na+2H2O═Na++2OH-+H2↑ | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+=Ca2++H2O+CO2↑ |
10.Na、Mg、Al的有关性质的叙述正确的是( )
| A. | 金属性:Na>Mg>Al | B. | 第一电离能:Na<Mg<Al | ||
| C. | 电负性:Na>Mg>Al | D. | 碱性:NaOH<Mg(OH)2<Al(OH)3 |
11.可用分液漏斗分离的一组化合物是( )
| A. | CCl4与水 | B. | AgCl悬浊液 | C. | 氯化钠与水 | D. | 酒精与水 |