题目内容
18.化学与环境、材料、信息、能源关系密切,下列说法中不正确的是( )| A. | 用O3替代Cl2作饮用水消毒剂更符合绿色化学的要求 | |
| B. | “光化学烟雾”、“臭氧空洞”的形成都与氮氧化合物有关 | |
| C. | 尽量使用含12C的产品,减少使用含13C或14C的产品符合“促进低碳经济”宗旨 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
分析 A.臭氧做还原剂,还原产物为氧离子;
B.氮的氧化物的排放能够引起光化学烟雾”、“臭氧空洞”;
C.“促进低碳经济”应开发和利用好新能源,减少化石燃料的燃烧,提高煤的使用率,减少污染性气体的排放,增大低碳和零碳技术的研发和产业,充分利用好可再生能源;
D.二氧化硅为酸性氧化物,能够与碱反应.
解答 解:A.臭氧做还原剂,还原产物为氧离子,为绿色消毒剂,故A正确;
B.氮的氧化物的排放能够引起光化学烟雾”、“臭氧空洞”,故B正确;
C.126C,136C,146C都是碳元素,不能减少碳的排放,故C错误;
D.二氧化硅为酸性氧化物,能够与碱反应,所以光导纤维遇强碱会“断路”,故D正确;
故选:C.
点评 本题考查了常见物质的性质和用途,熟悉臭氧、氮的氧化物、二氧化碳的性质是解题关键,注意低碳经济的含义,题目难度不大.

练习册系列答案
相关题目
9.下列说法不正确的是( )
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 叠氮酸(HN3)与醋酸酸性相似,NaN3水溶液中离子浓度大小顺序为c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| C. | 常温下向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中c(NH4+)=c(Cl-) | |
| D. | 常温下,等pH的CH3COONa、NaHCO3、NaClO三种溶液的浓度大小关系为c(NaClO)>c(NaHCO3)>c(CH3COONa) |
13.下列实验操作正确的是( )(填序号).
| A. | 用带橡皮塞的棕色试剂瓶存放浓硝酸 | |
| B. | 容量瓶、分液漏斗使用前均需检查是否漏水 | |
| C. | 分液漏斗分液时,必须先将下层液体从下口放出,再将上层液体从上口倒出 | |
| D. | 蒸馏时,需将温度计的水银球没入液面以下且不接触烧瓶壁 | |
| E. | 氨气喷泉实验时,收集气体的烧瓶必须干燥 | |
| F. | 用玻璃棒蘸取待测液,点在润湿的pH试纸上测定其pH |
10.二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为0.2mol.
②使用双氧水作还原剂的优点是使用双氧水作还原剂时氧化产物为氧气,对环境无污染.
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I-完全还原成Cl-;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
①步骤2发生反应的离子方程式为ClO2-+4H++4I-=2I2+Cl-+2H2O,滴入最后一滴标准溶液,溶液由蓝色变化为无色且半分钟不变化,加入指示剂的名称是淀粉溶液.
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含相同量CN-的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
(1)实验室合成ClO2常用盐酸或双氧水还原氯酸钠(NaClO3).
①盐酸和NaClO3反应时有ClO2和Cl2生成,反应的离子方程式为2ClO3-+4H++2Cl-=2ClO2↑+Cl2↑+2H2O,当反应中转移0.2mol 电子时,参加反应的还原剂的物质的量为0.2mol.
②使用双氧水作还原剂的优点是使用双氧水作还原剂时氧化产物为氧气,对环境无污染.
(2)ClO2可用于合成亚氯酸钠(NaClO2).将ClO2通入NaOH溶液中,并加入适量双氧水,在稳定装置中充分反应可制得NaClO2成品. 已知:当pH≤2.0时,NaClO2能被I-完全还原成Cl-;二氧化氯(ClO2)是高效安全的饮用水消毒剂,得到越来越广泛的应用.回答下列问题:
溶液中Na2S2O3能与I2反应生成NaI和Na2S4O6.欲测定成品中NaClO2的含量,现进行如下操作:
| 步骤Ⅰ | 称取样品Wg配成溶液置于锥形瓶中,并调节PH≤2.0 |
| 步骤Ⅱ | 向锥形瓶中加入足量KI晶体,充分搅拌,并加入少量指示剂 |
| 步骤Ⅲ | 用c mol/L的Na2S2O3溶液滴定 |
②若上述滴定操作中平均消耗VmL Na2S2O3标准溶液,则成品中NaClO2的质量分数为$\frac{9.05×10{\;}^{-2}VC}{4W}$×100%(用含w、c、V的代数式表示).
(3)ClO2和Cl2均能将电镀废水中的CN-氧化为无毒的物质,自身被还原为Cl-.处理含相同量CN-的电镀废水,所需Cl2的物质的量是ClO2的2.5倍.
7.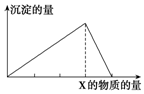 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
 将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )
将物质X逐渐加入(或通入)Y溶液中,生成沉淀的量与加入X的物质的量关系如图所示,符合图示情况的是( )| A | B | C | D | |
| X | CO2 | HCl | NaOH | AlCl3 |
| Y | Ca(OH)2 | AlO2- | AlCl3 | NaOH |
| A. | A | B. | B | C. | C | D. | D |
7.铬酸钙(CaCrO4)俗称钙铬黄,溶于水.广泛用作氧化剂、腐蚀抑制剂、颜料等.铬铁矿中铬的含量为19.5%,其主要成分为 FeO•Cr2O3,还含Fe2O3、SiO2、Al2O3等杂质,以该铬铁矿为原料制备钙铬黄的工艺流程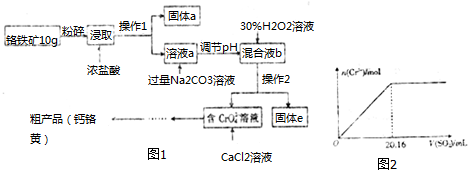
如图1已知:①过氧化氢能将Cr(OH)3氧化为CrO42-.
②金属离子氢氧化物开始沉淀时和沉淀完全时的pH及Ksp如下:
(1)将铬铁矿粉碎的目的是增大接触面积、提高浸取率.
(2)操作I的名称是过滤,固体a的主要成分是SiO2.
(3)写出浸取时生成Al3+的离子方程式:Al2O3+6H+=2Al3++3H2O.
(4)调节pH的范围是C.
A.3.5〜4.0 B.4.6〜5.4 C.5.9〜7.5
(5)写出H2O2氧化Cr(OH)3生成Na2CrO4的化学方程式2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑.
(6)当溶液中Al3+开始沉淀时,c(Fe3+)=2.5×10-8mol/L.
(7)取粗产品用硝酸酸化,再加水配制成1000mL溶液,取20mL于试管中,通入标准状况下SO2的体积与铬离子(Cr3+)物质的量的关系如图2该工艺流程中铬铁矿中铬的利用率是80%.[已知氧化性:CrO42->NO3 (H+)].

如图1已知:①过氧化氢能将Cr(OH)3氧化为CrO42-.
②金属离子氢氧化物开始沉淀时和沉淀完全时的pH及Ksp如下:
| 氢氧化物 | Ksp | 开始沉淀时的pH | 沉淀完全的pH |
| Fe(OH)3 | 2.5×10-38 | 2.3 | 3.5 |
| Fe(OH)2 | 1.0×10-15 | 7.5 | 9.5 |
| Al(OH)3 | 2.0×10-32 | 4.0 | 5.4 |
| Cr(OH)3 | 5.4×10-31 | 4.6 | 5.9 |
(2)操作I的名称是过滤,固体a的主要成分是SiO2.
(3)写出浸取时生成Al3+的离子方程式:Al2O3+6H+=2Al3++3H2O.
(4)调节pH的范围是C.
A.3.5〜4.0 B.4.6〜5.4 C.5.9〜7.5
(5)写出H2O2氧化Cr(OH)3生成Na2CrO4的化学方程式2Cr(OH)3+3H2O2+2Na2CO3=2Na2CrO4+6H2O+2CO2↑.
(6)当溶液中Al3+开始沉淀时,c(Fe3+)=2.5×10-8mol/L.
(7)取粗产品用硝酸酸化,再加水配制成1000mL溶液,取20mL于试管中,通入标准状况下SO2的体积与铬离子(Cr3+)物质的量的关系如图2该工艺流程中铬铁矿中铬的利用率是80%.[已知氧化性:CrO42->NO3 (H+)].