题目内容
(12分)近年来雾霾天气在秋冬季节经常肆虐我国中东部地区。其中,汽车尾气和燃煤是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO (g)  2CO2 (g) +N2 (g)
2CO2 (g) +N2 (g)
在某密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。

据此判断:
①该反应的平衡常数表达式为 。
②该反应的ΔH 0(选填“>”、“<”)。
③当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在右图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。
①煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。
CH4(g)+2NO2(g) = N2(g)+CO2(g)+2H2O(g)  =-867kJ·mol-1
=-867kJ·mol-1
2NO2(g)  N2O4(g)
N2O4(g)  =-56.9kJ·mol-1
=-56.9kJ·mol-1
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式 。
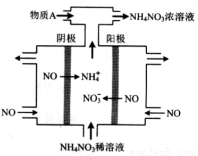
②将燃煤产生的二氧化碳回收利用,可达到低碳排放的目的。右图是通过光电转化原理以廉价原料制备新产品的示意图。

写出上述光电转化过程的化学反应方程式 。催化剂a、b之间连接导线上电子流动方向是 (填a→b或b→a) 。
(1)① (2分) ②<(2分)
(2分) ②<(2分)
③ (2分)
(2分)
【起点在原点O处(给1分),达到平衡的时间迟于“T2、S1”曲线的平衡点(给1分)】
(2)① CH4(g)+N2O4(g) = N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ/mol(2分)
②2CO2+2H2O 2HCOOH+O2(2分) a→b (2分)
2HCOOH+O2(2分) a→b (2分)
【解析】
试题分析:(1)①化学平衡常数是可逆反应达到平衡状态时生成物浓度幂之积与反应物浓度的幂之积的比。则反应2NO(g)+2CO (g)  2CO2 (g) +N2 (g)的平衡常数表达式为
2CO2 (g) +N2 (g)的平衡常数表达式为 ;② 根据图像可知:在催化剂的表面积(S)相同时,反应在温度为T1时首先达到平衡。由于温度越高,化学速率越快,达到平衡所需要的时间越短,所以反应温度为T1>T2,升高温度,平衡向吸热反应方向移动,由于升高温度,C(CO2)的平衡浓度降低,说明升高温度平衡逆向移动,逆反应方向是吸热反应,所以该反应的ΔH<0;(2)①第一个式子减去第二个式子,整理可得:CH4(g)+N2O4(g) = N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ/mol;②根据图示可知反应物是CO2、H2O,生成物是HCOOH和O2,则根据质量守恒定律可得上述光电转化过程的化学反应方程式是2CO2+2H2O
;② 根据图像可知:在催化剂的表面积(S)相同时,反应在温度为T1时首先达到平衡。由于温度越高,化学速率越快,达到平衡所需要的时间越短,所以反应温度为T1>T2,升高温度,平衡向吸热反应方向移动,由于升高温度,C(CO2)的平衡浓度降低,说明升高温度平衡逆向移动,逆反应方向是吸热反应,所以该反应的ΔH<0;(2)①第一个式子减去第二个式子,整理可得:CH4(g)+N2O4(g) = N2(g)+CO2(g)+2H2O(g) ΔH=-810.1 kJ/mol;②根据图示可知反应物是CO2、H2O,生成物是HCOOH和O2,则根据质量守恒定律可得上述光电转化过程的化学反应方程式是2CO2+2H2O 2HCOOH+O2;根据图示可知:H2O中的O在催化剂a失去电子,CO2中的C在催化剂b上得到电子变为HCOOH。所以a、b之间连接导线上电子流动方向是a→b。
2HCOOH+O2;根据图示可知:H2O中的O在催化剂a失去电子,CO2中的C在催化剂b上得到电子变为HCOOH。所以a、b之间连接导线上电子流动方向是a→b。
考点:考查化学平衡常数的表达、化学方程式、热化学方程式的书写、温度与反应进行的方向的关系、光电转换的电子转移的方向的知识。

 2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
2H2(g)+S2(g) ΔH >0,其他条件不变,下列说法正确的是
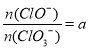 ,则n(Cl-)=____mol(用含a的代数式来表示)。
,则n(Cl-)=____mol(用含a的代数式来表示)。