题目内容
10.铁有多种价态,将14.4g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到7.2g铁的氧化物,则该铁的氧化物是( )| A. | Fe3O4 | B. | Fe2O3 | C. | FeO | D. | FeO和Fe3O4 |
分析 化学变化前后元素质量不变,14.4g FeC2O4中铁元素的质量与7.2g铁的氧化物中铁元素的质量相等,由此可计算出铁的氧化物中铁与氧两元素的质量比,再由质量比计算出原子个数比而确定物质的化学式.
解答 解:14.4gFeC2O4中铁元素的质量=14.4g×$\frac{56}{56+12×2+16×4}$=5.6g,
铁的氧化物中铁与氧两元素的质量比=5.6g:(7.2g-5.6g)=56:16,
铁的氧化物中铁与氧两元素的原子个数比=$\frac{56g}{56g/mol}$:$\frac{16g}{16g/mol}$=1:1,
则该铁的氧化物是FeO,
故选C.
点评 本题以物质确定为载体,考查化学式的有关计算、化学方程式计算等,难度不大,注意理解化学式表示的意义.

练习册系列答案
相关题目
20.下列有关物质的性质和该性质的应用均正确的是( )
| A. | 铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水 | |
| B. | 铜的金属活泼性比铁的差,可在海轮外壳上装若干铜块以减缓其腐蚀 | |
| C. | 明矾能水解生成Al(OH)3胶体,可用作净水剂 | |
| D. | 氯化铝是一种电解质,可用于电解法制铝 |
1.有一电化学装置如图所示,其中a、b、c、d均为石墨电极. 则下列有关说法正确的是( )


| A. | 甲烧杯中溶液的pH增大,乙烧杯中溶液的pH减小 | |
| B. | 电解一段时间后,b极质量增加,d极附近滴加酚酞溶液变红 | |
| C. | 甲烧杯中a电极发生氧化反应,电极反应式为:4OH-+4e-═O2↑+2H2O | |
| D. | C是阳极,电子从d电极通过溶液流向c电极 |
18.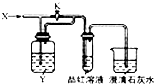 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
 向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( )
向图所示的装置中缓慢通入气体X,若打开活塞K,品红溶液褪色;若关闭活塞K,则品红溶液无变化而澄清石灰水变浑浊.X和Y可能是( ) | A | B | C | D | |
| X | SO2 | Cl2 | HCl | NO2 |
| Y | NaOH溶液 | 饱和NaCO3溶液 | 饱和NaCl溶液 | Na2SO3溶液 |
| A. | A | B. | B | C. | C | D. | D |
5.向Fe、FeO、Fe2O3的混合物中加入100mL1mol/L的盐酸,使之恰好完全溶解,放出224mL(标准状况下)的气体,在所得溶液中滴入硫氰化钾溶液无血红色出现(即无3价铁).若用足量CO 在高温下还原同质量的此混合物,能得到铁的质量是( )
| A. | 无法计算 | B. | 5.6g | C. | 2.8g | D. | 0.56 |
15.下列关于物质分类的表述,正确的说法是( )
| A. | 根据分散质粒子能否透过滤纸,可以将分散系分为溶液、胶体和浊液 | |
| B. | 根据某物质中是否含有氢元素,判断该物质是否属于酸 | |
| C. | 根据化学反应前后,是否有电子转移,判断反应是否属于氧化还原反应 | |
| D. | 根据某物质中是否含有氧元素,可以判断该物质是否属于氧化物 |
2.下列反应中,不属于氧化还原反应的是( )
| A. | 2Na+2H2O=2NaOH+H2↑ | B. | 3NO2+H2O=2HNO3+NO | ||
| C. | 2Al+2NaOH+6H2O=2NaAlO2+3H2↑ | D. | CaCO3=CaO+CO2↑ |
19.下列实验操作都能够达到预期目的是( )
①用pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
①用pH试纸测得某溶液pH为3.5
②用米汤直接检验食用盐中是否含有碘元素
③用pH试纸测定溶液的pH时,需先用蒸馏水润湿试纸
④滴入酚酞溶液确定纯碱中有无烧碱
⑤用酸式滴定管量取20.00mL高锰酸钾酸性溶液
⑥蒸干AlCl3溶液可得纯净的无水氯化铝.
| A. | ②④⑥ | B. | ②⑥ | C. | ⑤ | D. | ④⑤⑥ |
20.常温下,下列有关溶液的pH或微粒的物质的量浓度关系的判断不正确的是( )
| A. | pH=3的醋酸溶液与pH=11的NaOH溶液等体积混合,所得溶液的pH<7 | |
| B. | 某物质的溶液中由水电离出的c(H+)=1×10-amol•L-1,若a>7,则该溶液的pH一定为14-a | |
| C. | 将0.2mol•L-1的某一元酸HA溶液和0.1mol•L-1 NaOH溶液等体积混合后,混合溶液的pH大于7,则反应后的混合溶液中:2c(OH-)=2c(H+)+c(HA)-c(A-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合溶液的pH=7,则反应后的混合溶液中:2c(R2-)+c(HR-)=c(Na+) |