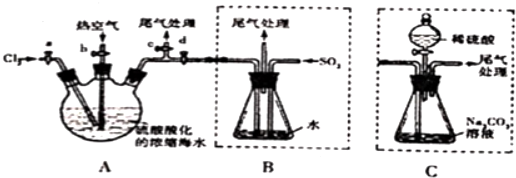
题目内容
5.向Fe、FeO、Fe2O3的混合物中加入100mL1mol/L的盐酸,使之恰好完全溶解,放出224mL(标准状况下)的气体,在所得溶液中滴入硫氰化钾溶液无血红色出现(即无3价铁).若用足量CO 在高温下还原同质量的此混合物,能得到铁的质量是( )| A. | 无法计算 | B. | 5.6g | C. | 2.8g | D. | 0.56 |
分析 盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl);用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2),据此结合m=nM计算得到的铁的质量.
解答 解:盐酸恰好使混合物完全溶解,盐酸没有剩余,向反应所得溶液加KSCN溶液无血红色出现,说明溶液为FeCl2溶液,根据氯元素守恒可知n(FeCl2)=$\frac{1}{2}$n(HCl)=$\frac{1}{2}$×0.1L×1mol/L=0.05mol;
用足量的CO在高温下还原相同质量的混合物得到铁,根据铁元素守恒可知n(Fe)=n(FeCl2)=0.05mol,质量为0.05mol×56g/mol=2.8g,
故选C.
点评 本题考查混合物的计算,难度中等,生成氢气体积为干扰数据,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
15.金属钛易于和肌肉长在一起,可用于制造各种人造关节,因此被称为“生物金属”.工业上由钛铁矿(主要成分为FeTiO3,含少量Fe2O3)制备钛的工艺流程如下:
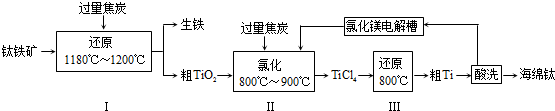
(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大反应速率.
(2)步骤Ⅰ中所发生的主要反应的化学方程式为FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑.
(3)将步骤Ⅱ中所发生的主要反应记为反应①,则①的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;有同学认为步骤Ⅱ中的物质转化中只需通入氯气,而无需加入焦炭就能实现,即发生反应②:TiO2+2Cl2 $\frac{\underline{\;高温\;}}{\;}$ TiCl4+O2.已知相关数据如下:
结合上表数据,从反应进行的方向角度分析加入焦炭的必要性加入焦炭后发生反应①,与反应②相比,△H减小,△S增大,更有利于反应在较低温度下向右进行.
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解;反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2(填化学式),即可制得海绵钛.

(1)进行步骤Ⅰ前,钛铁矿需要先粉碎成细颗粒,目的为增大反应速率.
(2)步骤Ⅰ中所发生的主要反应的化学方程式为FeTiO3+C$\frac{\underline{\;1180℃-1200℃\;}}{\;}$Fe+TiO2+CO↑.
(3)将步骤Ⅱ中所发生的主要反应记为反应①,则①的化学方程式为TiO2+2Cl2+2C$\frac{\underline{\;高温\;}}{\;}$TiCl4+2CO;有同学认为步骤Ⅱ中的物质转化中只需通入氯气,而无需加入焦炭就能实现,即发生反应②:TiO2+2Cl2 $\frac{\underline{\;高温\;}}{\;}$ TiCl4+O2.已知相关数据如下:
| 反应 | △H/kJ•mol-1 | △S/J•K-1•mol-1 |
| ① | -72.1 | +220 |
| ② | +149 | +41 |
(4)步骤Ⅲ中,反应物TiCl4应避免接触水,原因为防止TiCl4水解;反应结束后,用盐酸洗涤粗Ti,除去Mg、MgCl2(填化学式),即可制得海绵钛.
16.下列关于仪器使用的说法不正确的是( )
| A. | 振荡分液漏斗时应关闭其玻璃塞和活塞 | |
| B. | 滴定管装液滴定时应先用标准溶液润洗 | |
| C. | 蒸馏时温度计的水银球处于蒸馏烧瓶支管附近 | |
| D. | 锥形瓶用作反应容器时,一定不能加热 |
20.溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )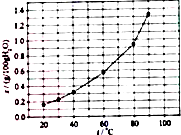

| A. | 溴酸银的溶解是吸热过程 | |
| B. | 温度升高时溴酸银溶解速度加快 | |
| C. | 60℃时溴酸银的Ksp约等于6×10-3 | |
| D. | 若硝酸钾中含有少量溴酸银,可用它们的溶解度随温度变化的差异进行分离 |
10.铁有多种价态,将14.4g草酸亚铁(FeC2O4)与空气隔绝加热分解,最终得到7.2g铁的氧化物,则该铁的氧化物是( )
| A. | Fe3O4 | B. | Fe2O3 | C. | FeO | D. | FeO和Fe3O4 |
17.在加入酚酞呈红色的某溶液中,能大量共存且溶液为无色透明的离子组是( )
| A. | H+、MnO4-、Na+、Cl- | B. | K+、Fe2+、NO3-、HCO3- | ||
| C. | Na+、K+、NO3-、SO42- | D. | Fe3+、Na+、Cl-、SO42- |
14.医学研究证明,用放射性$\stackrel{135}{53}$I治疗肿瘤可收到一定疗效,下列有关$\stackrel{135}{53}$I叙述正确的是( )
| A. | $\stackrel{135}{53}$I是碘的一种同素异形体 | |
| B. | $\stackrel{135}{53}$I是一种新发现的元素 | |
| C. | $\stackrel{135}{53}$I位于元素周期表中第四周期ⅦA族 | |
| D. | $\stackrel{135}{53}$I核内的中子数与核外电子数之差为29 |