题目内容
下列说法正确的是
A.SO2溶于水,其水溶液能导电,说明SO2是电解质
B.向纯水中加入盐酸或金属钠都能使水的电离平衡逆向移动,水的离子积不变
C.向氯水中加入Na2CO3可使溶液中c(HClO)增大
D.室温下,将浓度为0.1 mol·L-1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
C
【解析】
试题分析:A、SO2溶于水,其水溶液能导电,是因为SO2与H2O反应生成了电解质H2SO3,SO2不是电解质,故A错误;B、向纯水中加入金属钠,消耗了OH?,使水的电离平衡正向移动,故B错误;C、向氯水中加入Na2CO3,CO32?与H+反应,使平衡Cl2+H2O HCl+HClO向正反应方向移动,溶液中c(HClO)增大,故C正确;D、室温下,将浓度为0.1 mol·L-1HF溶液加水稀释,HF的电离平衡向右移动,则c(H+)/c(HF)增大,故D错误。
HCl+HClO向正反应方向移动,溶液中c(HClO)增大,故C正确;D、室温下,将浓度为0.1 mol·L-1HF溶液加水稀释,HF的电离平衡向右移动,则c(H+)/c(HF)增大,故D错误。
考点:本题考查电解质、弱电解质的电离平衡。

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案
相关题目

 Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。
Sn2+(aq)+Pb(s),体系中c(Pb2+)和c(Sn2+)变化关系如下图所示。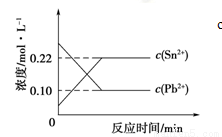


 Li1-xMn2O4+xLi
Li1-xMn2O4+xLi