题目内容
下列反应中硫酸既表现了氧化性,还表现了酸性的有( )
A、2H2SO4(浓)+Cu
| ||||
B、2H2SO4(浓)+C
| ||||
C、H2SO4(浓)+NaCl
| ||||
D、H2SO4+Na2SO3
|
考点:浓硫酸的性质
专题:元素及其化合物
分析:化学反应中硫酸体现氧化性和酸性,说明该反应中部分硫酸得电子化合价降低、部分硫酸化合价不变,据此分析解答.
解答:
解:A.该反应中部分浓硫酸中S元素化合价由+6价变为+4价、部分浓硫酸化合价不变,所以浓硫酸体现氧化性和酸性,故A正确;
B.该反应浓硫酸中S元素化合价由+6价变为+4价,所以浓硫酸只体现氧化性,故B错误;
C.该反应硫酸中各元素化合价不变,没有电子转移,不属于氧化还原反应,属于复分解反应,硫酸体现酸性,故C错误;
D.该反应硫酸中各元素化合价不变,没有电子转移,不属于氧化还原反应,属于复分解反应,硫酸体现酸性,故D错误;
故选A.
B.该反应浓硫酸中S元素化合价由+6价变为+4价,所以浓硫酸只体现氧化性,故B错误;
C.该反应硫酸中各元素化合价不变,没有电子转移,不属于氧化还原反应,属于复分解反应,硫酸体现酸性,故C错误;
D.该反应硫酸中各元素化合价不变,没有电子转移,不属于氧化还原反应,属于复分解反应,硫酸体现酸性,故D错误;
故选A.
点评:本题考查硫酸的性质,根据元素化合价是否变化来分析解答,易错选项是D,注意该反应中不能出现硫酸中S元素得电子、亚硫酸钠中S元素失电子现象,为易错点.

练习册系列答案
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案
相关题目
下列图示与对应的叙述不相符的是( )
A、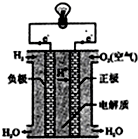 如图表示氢氧燃料电池构造示意图 |
B、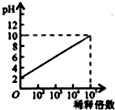 如图表示室温下pH=2的HCl溶液加水稀释倍数与pH的变化关系 |
C、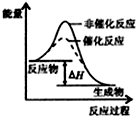 如图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
D、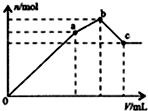 如图表示向NH4 Al(S04)2溶液中逐滴滴人Ba(OH)2溶液,生成沉淀总物质的量(n)随 着Ba(OH)2溶液体积(y)的变化 |
已知:Cu(s)+2H+(aq)═Cu2+(aq)+H2(g)△H=+64.39KJ?mol-1
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46KJ?mol-1
H2(g)
O2(g)═H2O(l))△H=-285.84KJ?mol-1
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H20(l)的反应热△H等于( )
2H2O2(l)═2H2O(l)+O2(g)△H=-196.46KJ?mol-1
H2(g)
| 1 |
| 2 |
在H2SO4溶液中,Cu与H2O2反应生成Cu2+(aq)和H20(l)的反应热△H等于( )
| A、-319.68kJ?mol-1 |
| B、-417.91kJ?mol-1 |
| C、+546.69kJ?mol-1 |
| D、-448.46kJ?mol-1 |
金属钠着火时,可以灭火的物质或器材是( )
| A、水 | B、砂子 |
| C、泡沫灭火器 | D、干粉灭火器 |
浓硫酸具有很强的吸水性,可作为气体干燥剂,但不能用浓硫酸干燥的气体是( )
| A、H2 |
| B、NH3 |
| C、N2 |
| D、HCl |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A、标准状况下,22.4 L H2O的分子数为1NA |
| B、物质的量浓度为0.5 mol?L-1的MgCl2溶液,含有Cl-数为1 NA |
| C、0.1molNa2O2晶体中阴离子数为6.02×1022 |
| D、常温常压下,14 g N2含有分子数为0.5 NA |


